(9ª Parte)
Novembro de 2001
3. FISIOLOGIA ESTOMÁTICA
(Cont.):
3.4.
RELAÇÕES OSMÓTICAS E BIOQUÍMICAS DAS CÉLULAS
DO COMPLEXO ESTOMÁTICO:
As alterações em Ypg e Ypn que originam os movimentos estomáticos podem ocorrer devido a alterações do potencial hídrico de um destes tipos de células (Yg ou Yn) ou devido a alterações dos seus potenciais osmóticos (Ypg ou Ypn). Devido à grande diferença de volume entre as células guarda e as vizinhas (as células guarda podem ser dez vezes mais pequenas), a abertura estomática é mais influenciada por alterações nos solutos das células guarda que nos das células vizinhas, apesar da vantagem mecânica destas últimas (Weyers & Meidner, 1990).
Muitos dados obtidos até agora mostram que o potencial osmótico das células guarda diminui, isto é, fica mais negativo quando os estomas abrem. Na fava (Vicia faba), foram registados valores de potencial osmótico de -1.9 MPa para estomas fechados e -3.5 MPa para estomas abertos. Como as células guarda praticamente duplicam o seu volume durante a abertura, este aumento da concentração de solutos ocorre apesar da diluição (Salisbury & Ross, 1992).
Em resumo, os estomas abrem devido à absorção de água pelas células guarda, e esta absorção é causada pela concentração de solutos que provoca uma diminuição do potencial osmótico.
3.4.1. OS SOLUTOS DAS CÉLULAS GUARDA NO MOVIMENTO ESTOMÁTICO:
Desde os anos 60 que se sabe que à medida que os estomas abrem, iões potássio (K+) se deslocam das células vizinhas para as células guarda (Salisbury & Ross, 1992). Na figura 36 podemos ver um esquema que representa as trocas do ião K+ e H+, entre as células guarda e as subsidiárias.

Figura 36: Mudanças quantitativas na
concentração em K+ (m = molal) e nos valores de pH dos vacúolos das
várias células que constituem o complexo estomático. São apresentados valores
para estomas abertos (à esquerda), e fechados (à direita).
Retirado de
Salisbury e Ross (1992), fig. 4.10, pag. 79
Na segunda metade dos anos 90, trabalhos realizados pela equipa de E. Zeiger na Universidade da California – L.A. chamaram a atenção para a importância da sacarose como osmótico no funcionamento estomático. Estudos sobre o conteúdo em solutos das células guarda mostraram que o potássio é mais importante no início do dia, mas depois a sua concentração diminui ao mesmo tempo que a concentração em sacarose aumenta, atingindo um pico na fase do dia em que a abertura estomática é máxima (figura 37).

Figura
37: Abertura dos estomas, conteúdo relativo em potássio
(K+) e em sacarose nas células guarda de folhas de faveira (Vicia
faba L.) ao longo do dia. O conteúdo em sacarose foi determinado por HPLC e
é expresso em pmoles por par de células guarda (GC). O K+ foi
determinado por coloração e está expresso em percentagem de área da célula
guarda coberta pela coloração.
Retirado
de Talbott & Zeiger (1998), fig.1, pag.330
Assim, segundo Talbott e Zeiger (1998) são quatro os solutos claramente implicados na osmoregulação das células guarda: o ião potássio (K+); o ião cloro (Cl-); o ião malato (malato–2) e a molécula de sacarose. O cloro e o malato funcionam como “counterions” do potássio, e o seu conteúdo relativo vai depender da espécie e das condições em que as plantas se desenvolveram. Assim, com excepção das Liliaceae, como a cebola (Allium cepa), que não acumulam amido nos seus cloroplastos e por isso utilizam exclusivamente o Cl-, o ião malato aparenta ser o “counterion” principal do K+.
O conteúdo relativo destes solutos
pode ser regulado, segundo estes autores, pelo menos por três vias distintas:
¨ A via do K+ e do Cl-:
Esta via envolve a absorção destes iões do apoplasto, e a síntese do ião malato a partir de “esqueletos” de carbono derivados da hidrólise do amido (figura 38). Esta via está associada com o abrir dos estomas, em folhas intactas, às primeiras horas do dia quando a luz é relativamente mais rica nos comprimentos de onda azuis (c.d.o.), ou em estomas isolados submetidos a luz azul ou branca.
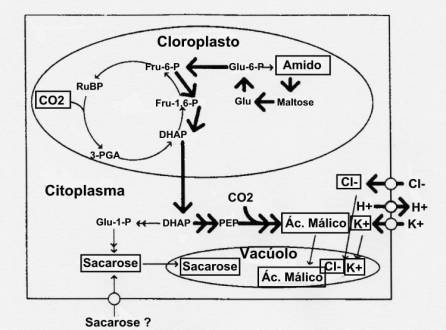
Figura 38:
Via de regulação do conteúdo das células guarda nos diferentes iões que ocorre
no início do dia em folhas intactas ou em estomas isolados quando iluminados
com luz azul ou branca. Nesta via o potássio (K+) e o cloro (Cl-)
são provenientes do apoplasto em associação com a extrusão de protões (H+)
enquanto que o ião malato é formado a partir da hidrólise do amido.
Retirado de Talbott & Zeiger (1998), fig. 3a), pag. 333
¨ A via da sacarose proveniente da hidrólise do amido:
Esta via pode ser inferida pelo facto da acumulação em sacarose não ser afectada pelo DCMU (3-(3,4-diclorofenil)-1,1-dimetilureia, agente que bloqueia o fluxo electrónico na fotossíntese) e pela hidrólise elevada do amido quando os estomas isolados são iluminados com luz azul (figura 39).
¨ A via da síntese de sacarose a partir de fotoassimilados nas célula guarda:
Nesta via a acumulação em sacrose é afectada pelo DCMU e ocorre na ausência de hidrólise de amido (figura 40). Esta via implicaria a capacidade das células guarda realizarem fotossíntese a taxas suficientemente elevadas para permitir explicar esta acumulação em sacarose.
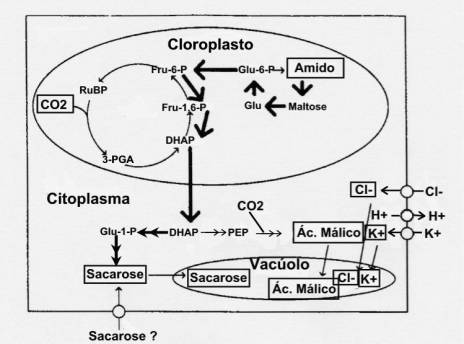
Figura
39: Via de osmoregulação das células guarda que opera em
fase mais adiantada da abertura estomática em ilumonação por luz azul e que
envolve a síntese de sacarose a partir da hidrólise amido.
Talbott
& Zeiger (1998), fig. 3b, pag.333
Se hoje em dia não há polémica sobre a importância da sacarose na abertura estomática, já o mesmo não se pode dizer sobre a sua origem. Para Ritte et al. (1999) o aumento de sacarose nas células guarda não pode ser explicado pela realização de fotossíntese, mas antes pela absorção deste açúcar do exterior e a partir da hidrólise do amido no interior das células guarda. Segundo estes autores, a redução fotossintética do carbono pode apenas explicar 10% do carbono reduzido necessário para abrir os estomas, se os solutos principais forem o K+ e o malato, e apenas 2% do carbono reduzido se os solutos principais forem hexoses. Estes autores observaram que protoplastos de células guarda de ervilheira (Pisum sativum L.) absorvem hexoses em simporte com protões. No entanto, este mecanismo só pode ser efectivo na manutenção da abertura estomática quando as taxas de fotossintese e transpiração são muito elevadas. Ou seja, este mecanismo seria insuficiente para explicar o iniciar da abertura estomática, mas permitiria manter os estomas abertos.
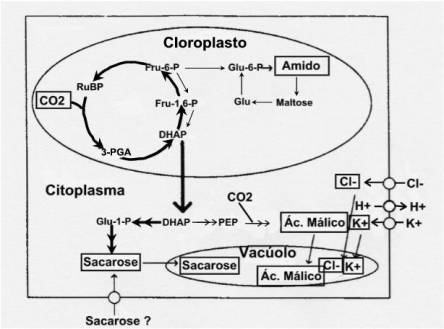
Figura
40: Via de
osmoregulação das células guarda observada em fase adiantada da abertura
estomática em folhas intactas ou em estomas isolados iluminados por luz
vermelha (luz actínica na fotossíntese).
Talbott
& Zeiger (1998), fig. 3c, pag.333
3.4.2.
MECANISMOS DO MOVIMENTO DOS SOLUTOS PARA DENTRO E PARA
FORA DAS CÉLULAS GUARDA:
¨ O potássio (K+)
Existem dados que
apontam para que a absorção de potássio pelas células guarda, quando os estomas
abrem, é condicionada pelo funcionamento duma bomba protónica dependente de
ATP, que exporta H+ para o exterior das células guarda (H+ATPase)
e que é activada pela luz vermelha e luz azul. Esta bomba protónica cria uma
hiperpolarização da membrana que leva à entrada de K+ para as
células guarda por canais
rectificadores de potássio em direcção ao interior (“inward-rectifying K+
channels” - ![]() ) (Schroeder et al., 2001).
) (Schroeder et al., 2001).
A saída do potássio
das células guarda devido à acção de factores que diminuem a abertura
estomática parece realizar-se devido a uma depolarização da membrana causada
pela saída de aniões por canais especializados, que causa por uma lado a
inibição de ![]() e por outro lado a
activação de canais rectificadores de potássio em direcção ao exterior
(“outwards-rectifying K+ channels” -
e por outro lado a
activação de canais rectificadores de potássio em direcção ao exterior
(“outwards-rectifying K+ channels” - ![]() ) (Schroeder et al., 2001).
) (Schroeder et al., 2001).
¨ O cloro (Cl-)
Nalgumas espécies o ião Cl- acompanha a entrada de potássio, para dentro das células guarda por cotransporte com protões ou antiporte com iões hidróxilo.
A saída do cloro das células guarda parece realizar-se através de dois tipos de canais para aniões (S-type e R-type) que resultam da depolarização da membrana devida a factores, como a hormona Ácido Abscísico (ABA), que estimulam o fecho estomático (Schroeder et al., 2001).
¨ O ião malato (malato2-)
O ião malato, como se viu
anteriormente, é sintetizado nas células guarda quando os estomas estão a abrir
à luz. Quando os estomas são induzidos a fechar o ião malato sai das células
guarda essencialmente devido aos canais de aniões que já vimos anteriormente
para o cloro.
¨ A sacarose
Existem dados que apontam que a
absorção de sacarose do apoplasto á volta das células guarda por simporte com
protões é suficiente para manter a abertura estomática (Ritte et al., 1999). Quando os estomas são
induzidos a fechar o transporte da sacarose é inibido e provavelmente a
sacarose presente nas células guarda é rapidamente metabolizada.
Caro Leitor:
Agradeço que me envie críticas,
sugestões e correcção dos erros que detectar. Para isso por favor “Clique aqui”
¨
Para
voltar ao Índice “Clique
aqui”
¨
Para
voltar para a 8ª Parte “Clique aqui”
¨
Para
avançar para a 10ª Parte “Clique aqui”
¨
Para
voltar à página pessoal de Alexandra Costa “Clique aqui”