(10ª Parte)
Novembro de 2001
3. FISIOLOGIA ESTOMÁTICA (Cont.):
3.5. FACTORES
QUE AFECTAM A ABERTURA ESTOMÁTICA:
Os estomas controlam a
difusão de CO2 para dentro das folhas para que possa ocorrer
fotossíntese e a difusão de vapor de água para fora das folhas no processo da
transpiração. Uma regulação eficaz da abertura estomática é fundamental para que
as plantas possam ter um bom desenvolvimento. Assim, as células guarda possuem
uma rede muito sofisticada de vias de sinalização que respondem a uma
multiplicidade de factores internos e externos, de forma a controlar a abertura
estomática. A compreensão desses factores e das respostas que induzem da parte
das células guarda constituem hoje em dia um dos campos de maior
desenvolvimento em Fisiologia Vegetal.
Atendendo à complexidade destas
respostas o seu estudo detalhado está fora do contexto destes apontamentos,
pelo que nos limitaremos a um estudo muito superficial dos principais factores
exógenos.
3.5.1.
CONCENTRAÇÃO EM CO2:
Os estomas são sensíveis à presença
de CO2, fechando sempre que a concentração em CO2 aumenta
quer na câmara estomática devido a um aumento da respiração mitocondrial, quer
devido a uma aumento do CO2 atmosférico.
Concentrações elevadas de CO2
causam um aumento da concentração de cálcio citosólico [Ca2+]cit,
este causa uma depolarização da membrana plasmática com a consequente activação
do canal de aniões do tipo S; da activação duma ![]() e da modulação dum
canal de aniões do tipo R (figura 41) (Cousson, 2000 e Schroeder, 2001).
e da modulação dum
canal de aniões do tipo R (figura 41) (Cousson, 2000 e Schroeder, 2001).
O(s) sensor(es) para o CO2
não estão ainda claramente definidos. Cousson em 2000 sugeriu que o aumento em
CO2 é sentido pelo decréscimo na produção e extrusão de protões
(figura 40), mas para outros autores os sensores poderão estar localizados nos
cloroplastos das células guarda onde causariam um decréscimo dos níveis do
carotenóide zeaxantina (Zhu et al., 1998, cit. em Schroeder, 2001), ou
ainda pela regulação da concentração em zeaxantina causada pela alteração da
taxa de fixação fotossintética do CO2 nos cloroplastos (Zeiger,
2000).
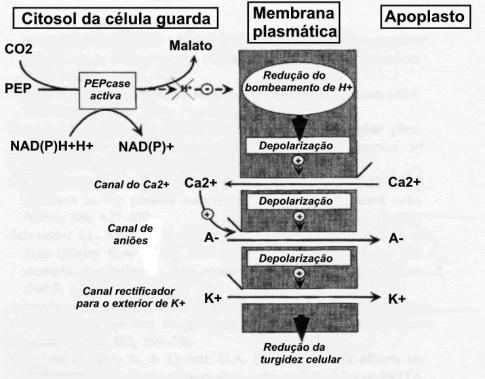
Figura 41:
Esquema demonstrativo dos processos de percepção e de transmissão envolvidos na
resposta das células guarda ao CO2. A-,
anião; PEP, fosfoenolpiruvato; PEPcase,
fosfoenolpiruvato carboxilase.
Retirado de Cousson (2000), fig. 10, pag. 494
3.5.2.
RADIAÇÃO:
Os estomas respondem à luz vermelha
e à luz azul aumentando as suas aberturas. Pensa-se que o receptor da luz
vermelha é a clorofila e o efeito da radiação com estes c.d.o. está
relacionado com a fotossíntese, quer directamente na redução fotossintética do
CO2 (Talbott & Zeiger, 1998) quer pelo aumento do teor em ATP
utilizado no funcionamento das H+-ATPase necessárias para a entrada
do K+ nas células guarda (Schroeder, 2001).
Demonstrou-se recentemente que o
receptor para a luz azul nas células guarda é um carotenoide – zeaxantina
– localizado nos cloroplastos. A absorção da luz azul causa uma reacção
fotoquímica, presumivelmente uma isomerização da molécula de zeaxantina que é o
primeiro passo na cascata de transmissão do sinal que terminará na activação
duma H+-ATPase (figura 42). Esta bomba protónica, como vimos
anteriormente, activará uma ![]() que causará o fluxo
de iões K+ para o interior da célula guarda (Zeiger, 2000).
que causará o fluxo
de iões K+ para o interior da célula guarda (Zeiger, 2000).
3.5.3. TEMPERATURA
Estudos da abertura estomática em função da
temperatura mostram um óptimo de temperatura bastante largo, entre os 32 e os
38 ºC, para muitas espécies. No entanto, a variação é pequena, sendo Q10
= 2 entre 18 e 35 ºC, e assim, os efeitos directos de pequenas mudanças de
temperatura (2 ou 3 ºC), são geralmente pouco significativos dentro desta gama
de valores (Sebanek, 1992).
Em contrapartida, os
efeitos indirectos podem ser muito importantes. Por exemplo, o aumento de
temperatura de apenas dois ou três graus, vai aumentar dras-ticamente o
gradiente de difusão do vapor de água, de que resulta um aumento da
trans-piração e possivelmente o aumento da carência hídrica da folha (Sebanek,
1992).
3.5.4. VENTO:
Os efeitos dos movimentos do ar nas
taxas de transpiração são muito complexas. O aumento do vento reduz a camada de
ar adjacente às folhas (“boundary
layer”), o que se traduz num aumento da transpiração, mas a longo prazo a taxa
de transpiração diminui devido ao fecho estomático (Kramer & Boyer, 1995).
3.5.5.
NUTRIÇÃO:
É importante um fornecimento
adequado de potássio durante o crescimento das plantas, devido especialmente às
suas funções no mecanismo estomático. As plantas que sofreram, durante o seu
desenvolvimento, duma carência nutricional em potássio não conseguem abrir
tanto os estomas como as restantes (Sebanek, 1992).
Para além do potássio, também uma carência em azoto altera o funcionamento estomático, possivelmente por aumentar a resistência radicular à entrada de àgua. Uma deficiência em fósforo causa um fecho estomático antes das folhas perderem a turgescência (Kramer & Boyer, 1995), pelo que este elemento deverá estar directamente envolvido na fisiologia das células guarda.
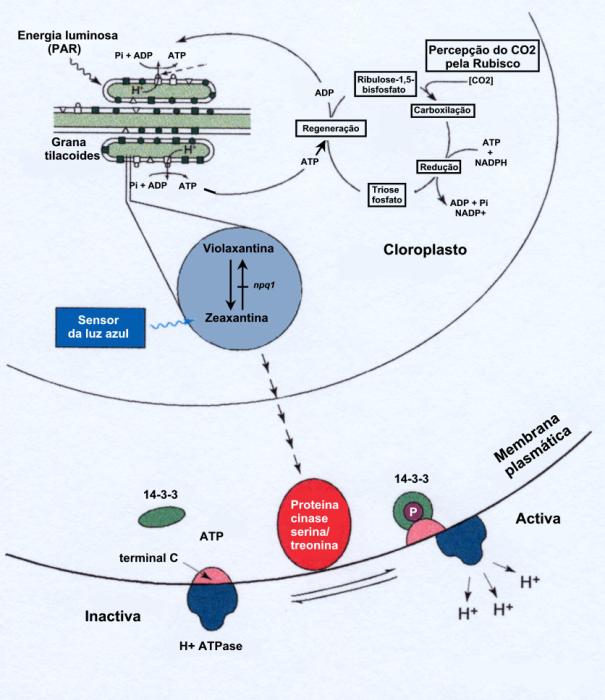
Figura 42: Transdução
da recepção da luz azul nas células guarda. A luz azul é sentida pelo
carotenoide zeaxantina na antena dos cloroplastos das células guarda.
Violanxantina e zeaxantina são os constituintes principais do ciclo das
xantofilas. O mutante de Arabidopsis thaliana npq 1 apresenta uma
deficiência na de-epoxidase da violaxantina e por isso não pode acumular
zeaxantina. A concentração nas células guarda em zeaxantina vai depender do pH
do lúmen dos cloroplastos, que é modulado pelas taxas do transporte electrónico
nas membranas dos tilacóides e pelo consumo de ATP e de NADPH na fixação de CO2
no Ciclo de Calvin. A regulação das concentrações em zeaxantina pela taxa de
fixação fotossintética do CO2 nos cloroplastos das células guarda
proporciona a estas células um mecanismo de detecção do CO2. A
grandeza da resposta à luz azul depende da concentração em zeaxantina e do
número de fotões azuis absorvidos. A cascata é iniciada pela excitação da
zeaxantina pela luz azul e o sinal é transmitido ao citoplasma onde activa uma
proteina cinase (serina/treonina). A proteina cinase fosforila o terminal C
duma H+-ATPase e, assim, activa a enzima. Uma proteina 14-3-3
liga-se à ATPase fosforilada e estabiliza-a. A desfosforilação dissocia a
proteina 14-3-3 e inactiva a H+-ATPase.
Retirado de Zeiger (2000), fig.1, pag. 184
O cálcio é um mensageiro secundário
de grande importância na fisiologia das células guarda, e uma carência
nutricional neste elemento vai causar grandes alterações no funcionamento dos
estomas.
3.5.6. HUMIDADE:
As células guarda reagem a
diferenças de humidade do ambiente muito rapidamente (figura 43). Assim, há
dados que apontam para uma maior abertura dos estomas de certas espécies,
quando em ambientes de elevada humidade relativa, e uma menor abertura em
ambientes mais secos (Kramer & Boyer, 1995)
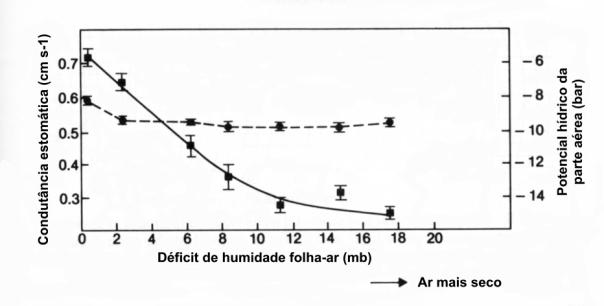
Figura 43: Resposta da condutância
estomática ( · ) à humidade relativa do ar. Esta resposta foi observada para um potencial
hídrico foliar ( < ), praticamente constante.
Retirado
de Willmer (1983), fig. 5.7, pag. 79
3.5.7.
DISPONIBILIDADE DO SOLO EM ÁGUA:
Pensou-se durante muito tempo que os
estomas respondiam à carência hídrica através da regulação da sua abertura de
acordo com o estado hídrico da planta. Hoje sabe-se que, este “feedback” não
existe. De facto, existem numerosos dados que mostram que várias espécies
fecham os estomas com a diminuição do teor em água do solo, mesmo que o estado
hídrico da planta não tenha mudado. Isto é, os estomas fecham mesmo quando as
folhas não estão em carência hídrica, desde que pelo menos parte do
sistema radicular esteja a experimentar falta de água (figura 44).
Esta resposta dos
estomas pode ser considerada como uma resposta feedforward, na qual um sinal das raízes que estão a sofrer seca é
transmitido às folhas, de modo a que estas reduzam a perda de água
(transpiração) antes da planta, como um todo, sofrer carência hídrica
(Mansfiels & Davies, 1985).
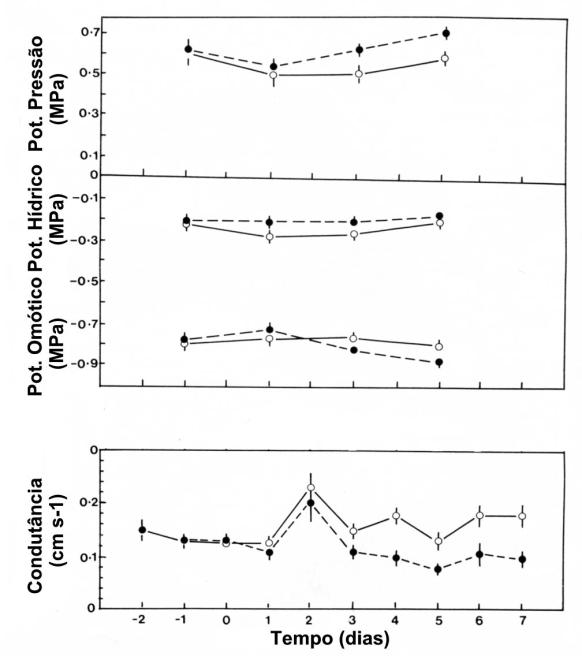
Figura 44: Potencial de pressão,
potencial hídrico (Y), potencial osmótico (Yp), e condutância estomática de folhas de plantas
de milho (Zea mays) cujo sistema
radicular foi dividido entre vasos. Num grupo destas plantas ambos os vasos
eram bem regados, permitindo que a totalidade do sistema radicular ficasse bem
regada ( ¢ ). Noutro grupo de plantas, apenas um dos vasos era regado, pelo que
metade do sistema radicular estava a sofrer carência hídrica ( l ).Retirado
de Mansfield e Davies (1985), fig. 5, pag. 161
Caro Leitor:
Agradeço que me envie críticas,
sugestões e correcção dos erros que detectar. Para isso por favor “Clique aqui”
¨
Para
voltar ao Índice “Clique
aqui”
¨
Para
voltar para a 9ª Parte “Clique aqui”
¨
Para
avançar para a 11ª Parte “Clique aqui”
¨
Para
voltar à página pessoal de Alexandra Costa “Clique aqui”