Les
mélanges, ce qu’il faut connaître absolument !
Objectif terminal 3.1
Distinguer mélange hétérogène de solution
(mélange homogène)
Objectif terminal 3.2
Décrire les caractéristiques d’une solution
définitions :
Pour distinguer un mélange hétérogène d’une solution, on peut avoir recourt aux modèles corpusculaires. Cependant, il est plus facile d’utiliser les caractéristiques qui les distinguent. Les caractéristiques d’une solution sont :
![]() Le mélange est limpide
Le mélange est limpide
![]() Une seule phase visible
Une seule phase visible
![]() Les particules sont réparties
uniformément à l’intérieur du mélange
Les particules sont réparties
uniformément à l’intérieur du mélange
![]() Les particules sont invisibles à
l’œil nu.
Les particules sont invisibles à
l’œil nu.

Le mélange A est un mélange hétérogène puisque ses particules ne sont pas réparties uniformément. C’est également un cas de sédimentation (voir procédés de séparation) A pourrait être de l’eau boueuse, un mélange d’huile et d’eau ou tout autre cas de mélanges de solides insolubles ou de liquides non miscibles.
La substance B n’est pas un mélange puisqu’elle est constituée d’un seul type de particule. B pourrait être de l’eau distillée (appelée aussi eau chimiquement pure).
Le mélange C est une solution saturée. Cela signifie que tous les espaces disponibles pour contenir le soluté sont comblés. Le surplus de soluté qui s’accumule au fond du récipient s’appelle résidu.
Le mélange D est un mélange homogène puisque son soluté est réparti uniformément à l’intérieur du solvant. Notez qu’il pourrait très bien s’agir d’un alliage (mélange de métaux) ou d’une solution (tout autres mélanges homogènes)
Masse volumique (r) On utilise très souvent la différence de pesée pour déterminer la masse volumique d’une substance.
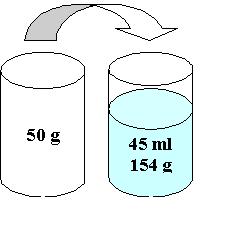
r = ![]() =
= ![]() = 2,31 g/ml
= 2,31 g/ml
Dans un mélange hétérogène, la masse volumique est aussi l’indice qui
nous explique l’ordre par lequel les substances se déposent.

Solubilité. La
solubilité est la quantité de soluté pouvant être dissoute dans 100 ml d’eau à
une température donnée. Les questions
sont rattachées à l’interprétation du tableau suivant.
Y _____
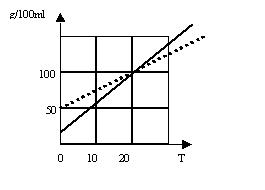
·
Quelle est la
solubilité de la substance X à 0°C?
environ 20 g/100ml
·
Quelle doit
être la température du solvant pour que la solubilité de Y soit de 100 g/100ml?
20°C
·
À quelle
température, X et Y ont la même solubilité?
20°C
·
Plus la
température augmente, plus la solubilité _____.
augmente.
Le professeur Halite réussit à dissoudre 3 différentes substances dans 20 ml d’eau à 23°C. Il dissout 17g de NaNO3, 6g de NaCl et 5g de KNO3. Quelle est la solubilité de chaque substance ?
réponses :
NaNO3 = ![]() =
= ![]() ou 85 g/100ml
ou 85 g/100ml
NaCl = ![]() =
= ![]() ou 30 g/100ml
ou 30 g/100ml
KNO3 = ![]() =
= ![]() ou 25 g/100ml
ou 25 g/100ml
Réponse :
le NaNO3 puisqu’il se dissout 85 g dans 100ml
Lorsque nous sommes
en présence d’un mélange homogène, la masse totale des constituants ne varie
pas alors que le volume total diminue légèrement.
Substance A :
masse=32g, volume=24ml
Substance B : masse=21g, volume=22ml
mélange
A+B :masse=53g, volume=45ml (au lieu de 46ml)
Objectif terminal 3.3
Démontrer que l’air pure est une solution
Il faut bien comprendre dans cette section que les constituants (ou solutés) de l’air (O2, CO2, H2O) sont répartis uniformément dans l’azote qui est en plus grande quantité, donc le solvant. De plus, l’air possède les caractéristiques(4) d’une solution. L’air est donc une solution.
Il faut retenir également que :
![]() L’eau de chaux permet de
détecter la présence de CO2 dans l’air
L’eau de chaux permet de
détecter la présence de CO2 dans l’air
![]() L’oxydation (le feux) permet de
détecter la présence de O2 dans l’air
L’oxydation (le feux) permet de
détecter la présence de O2 dans l’air
![]() La condensation permet de
détecter la présence de H2O dans l’air
La condensation permet de
détecter la présence de H2O dans l’air
Objectif terminal 3.4
Choisir le ou les bons précédés de séparation
d’un mélange homogène ou d’une solution
|
Caractéristiques |
Types |
procédés |
exemples |
|
constituants
insolubles ou non miscibles ayant des masses volumiques
différentes |
mélange
hétérogène |
Sédimentation
ou
décantation |
sable
+ eau huile
+ eau |
|
particules
solides en suspension dans le mélange |
mélange
hétérogène |
filtration |
filet
à papillon aspirateur |
|
Constituants
ayant des points d’ébullition différents |
Solution
|
Distillation |
eau + alcool pétrole |
Il est très important de retenir que le seul procédé capable de séparer les constituants d’une solution est une distillation !!!
Objectif terminal 3.5 et 3.6
Les usages des mélanges homogènes et
hétérogènes par les humains
Associe les exemples au bon mélange.
|
mélanges |
exemples |
|
|
réponses
1=a,c,d,g,h 2=f
3=b,e 4=a,c,d,g 5=h
Pollution : On nomme pollution une détérioration de l’environnement due à l’apparition d’une ou plusieurs substances nuisibles à la santé des êtres vivants.
Polluant : Toute substance présente en quantité suffisante pour devenir nuisible à la santé des êtres vivants.
Autres références pour l’étude
Prenez notes que ce document ce veut une référence sommaire pour la préparation de l’examen. Les éléments essentiels s’y trouve, mais il serait prudent de réviser également les pages suivantes et refaire quelques exercices.
Livres à la maison (bleu) : p 161 à 229
Rassemblons nos idées : pp 174, 190, 201, 210, 227
Cahier d’exercices : p137 à 183
Notes de cours :p 140A, 149A-B, 166A, 169A-B, p177A-B
Je suis également disponible par e-mail : patrick_leblond@hotmail.com
Horaire d’examen
Mardi, le 3 avril de 8h54 à 10h09 (jour 7)
|
202 |
A-303 |
|
203 |
A-305 |
|
204 |
A-306 |
|
206 |
A-403 |
Bonne chance pour votre examen
M. Leblond