Ley de los gases Ideales
Según la teoría atómica las moléculas pueden tener o no cierta libertad de movimientos en el espacio; estos grados de libertad microscópicos están asociados con el concepto de orden macroscópico. Las libertad de movimiento de las moléculas de un sólido está restringida a pequeñas vibraciones; en cambio, las moléculas de un gas se mueven aleatoriamente, y sólo están limitadas por las paredes del recipiente que las contiene.
Se han desarrollado leyes empíricas que relacionan las variables macroscópicas en base a las experiencias en laboratorio realizadas. En los gases ideales, estas variables incluyen la presión (p), el volumen (V) y la temperatura (T).
La ley de Boyle - Mariotte relaciona inversamente las proporciones de volumen y presión de un gas, manteniendo la temperatura constante: P1. V1 = P2 . V2
La ley de
Gay-Lussac afirma que el volumen de un gas, a
presión constante, es directamente proporcional a la temperatura absoluta:
![]() *
*
La
ley de Charles
sostiene que, a volumen constante, la presión de un gas es directamente
proporcional a la temperatura absoluta del sistema:
![]() *
*
* En ambos casos la temperatura se mide en kelvin (273 ºK = 0ºC) ya que no podemos dividir por cero, no existe resultado.
De las tres se deduce la ley universal de los gases:
![]()
Teoría Cinética de los Gases
El comportamiento de los gases, enunciadas mediante las leyes anteriormente descriptas, pudo explicarse satisfactoriamente admitiendo la existencia del átomo.
El volumen de un gas: refleja simplemente la distribución de posiciones de las moléculas que lo componen. Más exactamente, la variable macroscópica V representa el espacio disponible para el movimiento de una molécula.
La presión de un gas, que puede medirse con manómetros situados en las paredes del recipiente, registra el cambio medio de momento lineal que experimentan las moléculas al chocar contra las paredes y rebotar en ellas.
La temperatura del gas es proporcional a la energía cinética media de las moléculas, por lo que depende del cuadrado de su velocidad.
La reducción de las variables macroscópicas a variables mecánicas como la posición, velocidad, momento lineal o energía cinética de las moléculas, que pueden relacionarse a través de las leyes de la mecánica de Newton, debería de proporcionar todas las leyes empíricas de los gases. En general, esto resulta ser cierto.
La teoría física que relaciona las propiedades de los gases con la mecánica clásica se denomina teoría cinética de los gases. Además de proporcionar una base para la ecuación de estado del gas ideal. La teoría cinética también puede emplearse para predecir muchas otras propiedades de los gases, entre ellas la distribución estadística de las velocidades moleculares y las propiedades de transporte como la conductividad térmica, el coeficiente de difusión o la viscosidad.
Densidad de un gas
En un determinado
volumen las moléculas de gas ocupan cierto espacio. Si aumenta el volumen
(imaginemos un globo lleno de aire al que lo exponemos al calor aumentando su
temperatura), la cantidad de moléculas (al tener mayor espacio) se
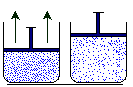 distribuirán de manera que encontremos menor cantidad en el mismo volumen
anterior. Podemos medir la cantidad de materia, ese número de moléculas,
mediante una magnitud denominada masa. La cantidad de moléculas, la masa, no
varía al aumentar o disminuir (como en este caso) el volumen, lo que cambia es
la relación masa - volumen. Esa relación se denomina
densidad (d).
La densidad es inversamente proporcional al volumen (al aumentar al doble el
volumen , manteniendo constante la masa, la densidad disminuye a la mitad) pero
directamente proporcional a la masa (si aumentamos al doble la masa, en un mismo
volumen, aumenta al doble la densidad).
distribuirán de manera que encontremos menor cantidad en el mismo volumen
anterior. Podemos medir la cantidad de materia, ese número de moléculas,
mediante una magnitud denominada masa. La cantidad de moléculas, la masa, no
varía al aumentar o disminuir (como en este caso) el volumen, lo que cambia es
la relación masa - volumen. Esa relación se denomina
densidad (d).
La densidad es inversamente proporcional al volumen (al aumentar al doble el
volumen , manteniendo constante la masa, la densidad disminuye a la mitad) pero
directamente proporcional a la masa (si aumentamos al doble la masa, en un mismo
volumen, aumenta al doble la densidad).
![]()