3. ISKEMIA SEREBRAL
DAN REKONSTRUKSI VASKULER
Kelainan cerebro-vaskuler adalah penyebab kematian dan
kesakitan yang utama di dunia barat dan berbagai
rekonstruksi dilakukan untuk memperbaiki akibat dari
arteriosklerosis pada arteria karotid dan vertebral
seperti juga yang harus dilakukan intrakranial.
Walau otak manusia hanya 2 % dari berat badan
total, ia memerlukan 20 % oksigen yang diinspirasi saat
istirahat, 15 % curah jantung (sekitar 750 mL/menit),
dan seluruh keluaran glukosa hati saat puasa. Karena
tidak mempunyai cadangan glikogen, ia tergantung pada
fosforilasi oksidatif untuk memproduksi fosfat energi
tinggi. ADS istirahat sekitar 50 mL/100g jaringan otak
permenit. Walau ADS total relatif stabil dalam berbagai
aktifitas badan, curah jantung, dan tekanan darah, ADS
fokal sangat berkaitan dengan metabolisme dan meningkat
tajam pada aktifasi daerah korteks.
Pada praktek bedah saraf, etiologi iskemia
serebral akuta dapat dibagi kedalam tiga kategori umum.
Pertama, penyebab tersering iskemia serebral adalah
strok embolik atau trombotik, biasanya karena
aterosklerosis atau penyakit kardiak. Kategori kedua
adalah gangguan vaskuler perioperatif selama tindakan
bedah saraf seperti diseksi arterial atau trombosis,
atau oklusi temporer vaskuler yang lama. Kategori utama
ketiga dari iskemia serebral akuta adalah defisit
iskemik tunda yang diinduksi perdarahan subarakhnoid,
sekunder akibat vasospasme. Pada semua kategori utama
tadi, pengelolaan intensif terdiri dari intervensi
untuk meninggikan ADS atau memberikan perlindungan
neuronal langsung.
Indikasi utama operasi adalah serangan iskemik
transien (TIA) dimana sebagian besar pasien akan menuju
strok lengkap (CS). Kelainan sirkulasi karotid lebih
sering dibanding vertebro-basiler dan kemungkinan
stroknyapun juga lebih besar.
TIA adalah episode defisit neurologis fokal
disebabkan iskemia serebral dan berakhir dalam kurang
dari 24 jam. Ini merupakan satu sisi dari spektrum
iskemia serebral, sedang sisi lainnya adalah infarksi
serebral dan strok sempurna (CS). Sedangkan defisit
neurologis iskemia yang reversibel (RIND) adalah gejala
atau tanda neurologis fokal yang berakhir 24-48 jam.
TIA mungkin bermanifes dengan berbagai gejala
neurologis. Bila iskemia mengenai daerah distribusi
arteria karotid (yaitu sirkulasi serebral anterior;
termasuk arteria oftalmik, dan arteria serebral media),
gejala mungkin berupa kebutaan monokuler transien
(amaurosis fugax), kelemahan atau kelainan sensori pada
ekstremitas atau pada satu sisi tubuh atau muka,
gangguan berbahasa atau kognisi, dll. Gejala seperti
vertigo, mual, ataksia, disartria, diplopia serta
disfagia bila transien mungkin menunjukkan iskemia
teritori sirkulasi vertebro-basiler (yaitu sirkulasi
posterior). Gejala perasaan kepala yang 'ringan' atau
pusing tanpa vertigo, walau mungkin berarti adanya
iskemia serebral umum, tidak cukup terlokalisir untuk
mengarahkan pada dugaan suatu TIA.
Etiologi TIA belum sepenuhnya jelas. Pernah diduga
bahwa stenosis arteria karotid mengakibatkan aliran
darah serebral yang tidak cukup atau berubah-ubah
menyebabkan gejala, dimana hal ini mungkin terjadi pada
beberapa kasus. Teori mutakhir menduga adanya emboli
arteri ke arteri menjadi penyebab pada kebanyakan TIA.
Emboli ini mungkin berasal dari semua sumber antara
jantung dan otak dan mungkin termasuk emboli dari
suatu miksoma atrial atau vegetasi katup mitral pada
endokarditis bakterial subakuta atau jarang-jarang
emboli vena periferal pada pasien dengan defek septal
atrial atau ventrikuler. Lebih sering sumber emboli
adalah plak ateromatosa yang terjadi pada atau dekat
bifurkasi arteria karotid komunis. Agregasi platelet-
fibrin dan/atau fragmen kolesterol mungkin jadi emboli
keotak terutama berasal dari plak yang pada angiogram
memperlihatkan ulserasi. Emboli ini tersangkut pada
arteriola kecil pada otak atau retina, menyumbat aliran
darah dan karenanya akan menyebabkan gejala yang
terlokalisir. Gejalanya transien karena emboli mungkin
hancur dan tersebar atau kanal vaskuler kolateral kecil
mungkin terbuka akibat iskemia vokal dan memberikan
aliran darah yang cukup untuk menghilangkan gejala.
Pada keadaan kebutaan monokuler transien, emboli
kolesterol mungkin tampak pada sirkulasi retinal.
Bruit servikal terjadi pada 4% populasi berusia 40
tahun atau lebih tua. Prevalensi meningkat dengan usia
dan adanya hipertensi. Walau bruit servikal ini
menandakan adanya stenosis karotid, stenosis ini tidak
selalu jelas. Pasien dengan bruit servikal dan tanpa
gejala TIA atau strok, tingkat strok yang akan terjadi
adalah 2%. Pada pasien ini lokasi strok berikutnya
hampir tidak ada hubungannya dengan sisi bruit.
Kelompok dengan bruit servikal serta adanya stenosis
berat arteria karotid risikonya bertambah terhadap
strok.
Pasien dengan bruit karotid asimtomatik mempunyai
tingkat iskemik miokardial 7% pertahun dan mortalitas
tahunannya 4%, kebanyakan karena kelainan jantung.
Adanya bruit arteria karotid pada pasien tanpa gejala
neurologis harus diingat sebagai pertanda adanya
kelainan vaskuler aterosklerotik menyeluruh dan tidak
dipertimbangkan untuk operasi karotid. Pasien dengan
bruit karotid harus dilakukan penilaian ultrasonik atau
angiografik untuk menentukan derajat stenosis.
TIA dan bruit servikal adalah prediktor kelainan
aterosklerotik yang menyeluruh. Pada pasien dengan TIA,
kelainan iskemik kardiak menyebabkan kematian lebih
dari dua kali dibandingkan karena strok. Pasien dengan
bruit asimtomatis, tingkat strok tahunannya 2%, tingkat
iskemik miokardialnya 7%, dan mortalitas tahunannya 4%.
Korelasi antara sisi bruit dengan sisi strok berikutnya
adalah buruk. Pada pasien dengan TIA, tingkat strok
tahunannya 5-10% dan mortalitas tahunannya 6%.
TIA berhubungan dengan:
1. Kelainan karotid ekstrakranial:
a. Oklusi lengkap arteria karotid komunis atau internal.
b. Stenosis karotid internal pada bifurkasi.
c. Plak ateroma yang mengalami ulserasi pada bifurkasi
melepaskan emboli kolesterol dan platelet.
2. Penyebab kardiak:
a. Emboli dari jantung akibat dari kelainan valvuler
kongenital atau didapat.
b. Episode disritmia menyebabkan hipotensi transien.
3. Kelainan arteria karotid intrakranial dan serebral
media.
Pasien dengan TIA berulang yang bukan karena penyebab
kardiak atau kelainan sistemik seperti hipertensi,
polisitemia atau anemia yang berhasil diobati mengatasi
serangannya, harus dilakukan aortografi arkus. Hasil
yang didapat pada operasi stenosis karotid paling
tinggi pada yang memiliki bruit karotid.
Yang pertama-tama harus dilakukan pada pasien TIA
adalah CT scan kepala dengan dan tanpa kontras intra
vena untuk menyingkirkan adanya lesi massa. Lesi massa
seperti tumor primer atau metastatik, abses, anomali
vaskuler, atau bahkan perdarahan intrakranial mungkin
mula-mula tampil dengan gejala fokal transien.
Dalam menilai pasien dengan iskemia serebral
transien, perhatian harus langsung diarahkan pada
sistema kardiak dan serebrovaskuler. Ekhokardiografi
dilakukan untuk melacak kemungkinan sumber emboli
kardiak. Ultrasonografi doppler adalah cara noninvasif
untuk menilai patensi arteria karotid, namun angiografi
tetap sebagai teknik imaging definitif untuk menilai
arteria karotid.
PATOFISIOLOGI CEDERA OTAK ISKEMIK
Penting untuk mengetahui perbedaan yang jelas antara
iskemia serebral fokal dan global. Keadaan klinis khas
pada iskemia fokal adalah bahwa ia terjadi karena
oklusi embolik arteria serebral media (MCA). Iskemia
global terjadi pada pasien henti kardiak. Pada iskemia
global tidak ada ADS selama keadaan iskemik, sebaliknya
pada iskemia fokal yang potensial akan adanya aliran
darah residual yang berkekuatan rendah dari sirkulasi
kolateral. Perfusi residual pada iskemia fokal
memungkinkan pengangkutan substrat yang memadai untuk
mempertahankan aktifitas metabolik berkadar rendah yang
mempertahankan integritas membran dan karenanya
menghambat evolusi cedera neuronal yang irreversibel.
Namun aliran darah residual yang berkemampunan rendah
ini menimbulkan keadaan biokimia yang kompleks yaitu
metabolisme glukosa dalam keadaan anaerobik yang
mungkin memperburuk asidosis otak. Tinjauan berikut
hanya dititikberatkan pada patofisiologi iskemia
serebral fokal karena merupakan keadaan klinis yang
lebih sering ditindak bidang bedah saraf.
Ambang Rangsang Iskemia
1948, Kety dan Smith mendemonstrasikan bahwa ADS
manusia sekitar 50 mL/100g jaringan otak/menit. Juga
diperlihatkan pada pasien pasca endarterektomi karotid
pengurangan ADS hingga 18 mL/100g jaringan otak/menit
menyebabkan pengurangan atau penekanan pada EEG.
Penurunan hingga 15 mL/100g jaringan otak/menit akan
menekan potensial evok somatosensori. Karenanya ambang
rangsang gagal elektrik senilai antara ADS kritis 18-
15 mL/100g jaringan otak/menit. Penelitian lebih baru
memperlihatkan bahwa ambang rangsang gagal elektrik
dapat diulang namun akan bervariasi tergantung jenis
dan derajat anestesia. 1977 Astrup memperlihatkan
pengurangan hingga 12-10 berakibat penurunan nyata pada
konsentrasi ionik ekstraseluler dari kation seperti K+
dan Ca++. Tingkat pengurangan kedua dari aliran darah
adalah ambang rangsang gagal ionik. Karena jaringan
neuronal secara kritis tergantung penyediaan sinambung
dari glukosa dan oksigen untuk metabolisme aerobik,
penurunan ADS hingga 12-10 berakibat penghabisan yang
cepat dari ATP. Dengan pemusnahan ATP, terjadi gagal
pompa Na+/K+ase, yang penting untuk mempertahankan
gradien ionik. Karena perbedaan konsentrasi ekstra-
seluler dan intraseluler dari kedua kation ini, terjadi
efluks K+ bersama influks Na+ kedalam neuron yang akan
menyebabkan depolarisasi membran. Sebagai tambahan
terhadap fluks ionik inisial ini, terjadi peninggian
yang cepat dari konsentrasi asam laktat intraseluler
akibat metabolisme anaerobik. Selama pengurangan yang
berat dari ADS, konsentrasi asam laktat meningkat empat
kali dalam 30 menit. Bila iskemia berlangsung lama,
konsentrasi asam laktat terus meninggi hingga sekitar
14 umol/g jaringan otak. Walaupun toleransi jaringan
neuronal terhadap pengurangan aliran pada sekitar
10 mL/g jaringan otak/menit tidak diketahui, penelitian
menunjukkan bahwa setelah 3-4 jam, cedera neuronal
irreversibel mungkin terjadi. Nyatanya daerah otak yang
spesifik terancam luar biasa oleh tingkat aliran yang
rendah. Misalnya neuron CA 4, CA 3, dan CA 1 hipokampal
memperlihatkan cedera neuronal iskemik setelah 3-5
menit pengurangan aliran yang berat.
Antara kedua ambang rangsang, gagal elektrik dan
gagal ionik, terdapat jangkauan berbatas tegas dari ADS
yang walaupun dengan kehilangan fungsional, homeostasis
membran dan integritas struktural dapat dipertahankan.
Daerah ADS terbatas ini disebut 'penumbra iskemik'.
Konsep ini bisa menjelaskan mengapa pasien dengan strok
akut mempunyai potensi membaik bila terdapat aliran
kolateral yang memadai untuk menjamin keperluaan energi
basal untuk mempertahankan integritas membran. Contoh
klinis terbaik dari penumbra iskemik adalah penderita
defisit neurologis iskemik reversibel (RIND). Mungkin
selama RIND, ADS berkurang dibawah ambang rangsang
gagal elektrik dan pasien memiliki defisit neurologis.
Namun karena pasien membaik, beralasan mempostulasikan
bahwa terdapat ADS kolateral memadai untuk menghambat
infarksi serebral. Istilah penumbra iskemik adalah
untuk menjelaskan suatu zona parenkhima yang secara
elektrik sunyi, namun secara struktur intak disekitar
daerah infarksi selama keadaan iskemik serebral fokal
akuta. Namun pertanyaan tentang kestabilan penumbra
iskemik tetap tak terpecahkan. Lebih mutakhir, penumbra
iskemik dikhususkan kedalam dua keadaan. Jenis 1
dimanifestasikan oleh supresi EEG, pengurangan ADS, dan
tetap utuhnya struktur neuronal. Jenis 2 ditentukan
oleh penekanan EEG, pengurangan ADS kritis, dan adanya
peninggian sementara yang berulang dari K+e. Penumbra
jenis 2 berhubungan dengan berbagai derajat kehilangan
neuronal. Saat memikirkan kestabilan penumbra iskemik,
elemen waktu harus turut dipertimbangkan. Misalnya
pengurangan aliran hingga 18 pada oklusi MCA permanen
Ambang Rangsang Iskemia
-------------------------------------------------------
Aliran darah serebral, Status fungsional
ml/100g/menit
50 | Normal
|
18 | Gagal elektrik
| EEG, SSEP /
|
| Penumbra iskemik
|
12 | Gagal metabolik
| Na+i / Ca++i /
! K+i / pHi /
-------------------------------------------------------
pada Makaka menyebabkan infarksi yang menggambarkan
baik penurunan ADS maupun toleransi yang buruk jaringan
neuronal terhadap pengurangan aliran darah yang lama.
Karenanya beralasan untuk menduga bahwa penumbra
iskemik nyatanya adalah keadaan dinamik yang berpotensi
memburuk setiap saat. Perburukan ini menggambarkan
perburukan progresif aliran darah kolateral residual
akibat kelemahan (fatigue) kolateral, vasokonstriksi
iskemik, atau edema progresif. Karenanya hasil akhir
klinis setelah oklusi vaskuler menunjukkan berat dan
lamanya pengurangan ADS. Beberapa penelitian dilakukan
untuk menentukan waktu maksimum oklusi MCA yang dapat
ditolerasi tanpa terjadinya infarksi. Penelitian baru-
baru ini menunjukkan bahwa oklusi MCA dapat ditolerasi
untuk 1 jam oleh tupai atau 6 jam oleh kucing tanpa
infarksi berat. Percobaan Makaka memperlihatkan bahwa
oklusi MCA 15-18 menit ditolerasi tanpa infarksi. Bila
oklusi MCA diteruskan hingga 30 menit, secara jarang
akan berakibat infark substansi kelabu subkortikal.
Bila dilanjutkan hingga 60 menit, akan terjadi cedera
neuronal dengan pola heterogen dari tanpa infarksi
hingga lesi makroskopis luas. Setelah oklusi MCA 4 jam,
terjadi infarksi nonkonfluen berganda mengenai baik
ganglia basal maupun substansi kelabu subkortikal. Bila
lebih dari 4 jam, terjadi infarksi yang berkonfluen
tunggal yang besar mengenai baik struktur otak dalam
maupun permukaan. Melihat penelitian iskemia fokal pada
primata menunjukkan oklusi MCA selama 30 menit dapat
ditolerasi dengan baik, sedangkan bila 60 menit sering
berakibat infark kecil berganda dengan lokalisasi
perivaskuler. Bila oklusi dilanjutkan hingga 4 jam,
infark mikro akan bergabung menjadi infark besar dan
mengenai baik struktur dalam maupun permukaan dari
distribusi MCA. Penelitian binatang juga memperlihatkan
bahwa reperfusi dan restorasi aliran darah dalam 4-8
jam dapat memperbaiki perluasan infarksi. Penting
dicatat bahwa reperfusi mungkin mengeksaserbasi derajat
cedera otak. Misalnya oklusi MCA primata, reperfusi
setelah 3-6 jam iskemik cenderung meningkatkan derajat
edema vasogenik. Dihipotesakan bahwa cedera reperfusi
mungkin akibat reoksigenasi dengan dibentuknya radikal
bebas.
Perubahan Metabolik
Keadaan metabolik yang merugikan yang terjadi selama
pengurangan aliran darah berat adalah multifaktor dan
kompleks. Gangguan metabolik utama inisial adalah
asidosis otak, perubahan permeabilitas membran terhadap
Ca++ dan Na+, dan pelepasan Ca++i yang tersekuester.
Pada nyatanya semua berhubungan dengan gagal energi.
Misalnya pelepasan asam amino eksitatori, pembukaan
kanal kalsium membran bergantung tegangan, dan asidosis
intraseluer, semua dapat berkaitan dalam menggagalkan
metabolisme aerobik akibat dari pemusnahan ATP sekunder
terhadap penurunan penyediaan oksigen dan glukosa.
Sekarang sudah dipastikan bahwa Ca++ berperan
kritis pada peristiwa seluler normal yaitu pembawa
sekunder, regulator metabolik, dan penyebab pelepasan
neurotransmiter. Juga diketahui bahwa akumulasi Ca++
abnormal dapat menghantar kematian anoksik. Tahun 1977
telah diperlihatkan bahwa konsentrasi Ca++ ekstra-
seluler menurun pada korteks serebeler yang hipoksik.
Diperlihatkan bahwa Ca++ juga berkurang pada anoksia
hipokampal, status epileptikus, dan hipoglikemia. Hal
ini berakibat timbulnya hipotesis integratif mengenai
kerusakan sel yang berhubungan dengan kalsium, sebagai
perjalanan umum cedera neuronal. Dihipotesakan bahwa
Ca++ memasuki neuron melalui kanal kalsium bergantung
tegangan yang terbuka setelah depolarisasi membran.
Dalam keadaan anaerobik, pemusnahan yang cepat dari ATP
menyebabkan gagal pompa Na+/K+ase. Ini pada akhirnya
menyebabkan depolarisasi membran dengan adanya influks
kalsium. Karena Ca++i tersekuester dalam jumlah besar
diretikulum endoplasmik oleh Ca++ATPase, maka juga
dipostulasikan bahwa gagal energi akan melepaskan
kalsium intraseluler yang akan mempengaruhi cedera
neuronal yang tidak bergantung pada fluks kalsium
transmembran. Perbedaan kerusakan terhadap cedera
iskemik antara populasi neuronal berbeda dipostulasikan
sebagai akibat perbedaan kepadatan kanal kalsium
membran.
Hipotesis kalsium yang pertama dikemukakan untuk
cedera neuronal ini telah melalui beberapa penellitian.
Penelitian in vitro, pertama, memperlihatkan bahwa
neuron akan mati akibat kerusakan hipoksik pada medium
kultur bebas Ca++. Kedua, terdapat korelasi yang buruk
antara lokasi tertentu kanal kalsium bergantung
tegangan dan kerusakan iskemik. Ketiga, peran neuro-
transmiter seperti glutamat dan aspartat pada cedera
hipoksik telah diperlihatkan.
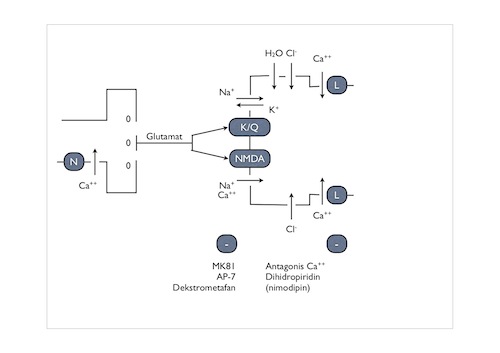
Skema
Hubungan antara gagal energi dan jalur metabolik
degradatif utama penyebab kerusakan neuronal iskemik.

Rothman dan Olney pertama menghipotesakan bahwa
asam amino tertentu seperti glutamat atau aspartat
adalah sitotoksik dan bila dibiarkan melakukan eksitasi
berlebihan dari reseptor postsinaptik, akan berakibat
kerusakan dendrosomatik. Hipotesis eksitotoksik ini
selanjutnya digunakan pada cedera anoksik dan hipo-
glikemik yang sesuai dengan konsep bahwa eksitasi
berlebihan dapat berakibat peningkatan pelepasan atau
penurunan pengambilan kembali dari neurotransmiter
sitotoksik. Mekanisme cedera eksitotoksik kemudian bisa
diterangkan oleh penelitian lain dimana ditemukan
bentuk dini dan tunda dari cedera ireversibel. Cedera
dini disebabkan oleh influks Na+ dan cedera tunda oleh
entri Ca++.
Paling tidak ada tiga reseptor untuk asam amino
eksitotoksik ini yang dijelaskan secara farmakologi
dengan ikatan analog: Reseptor N-metil-D-aspartat
(NMDA), asam kainik/quisquolat, dan AMPA. Pada hipo-
tesis eksitotoksik dari cedera neuronal iskemik,
kerusakan sel dini dipengaruhi oleh influks Na+ diikuti
entri Cl- dan H2O dengan akibat edema seluler dan osmo-
lisis. Influks Na+ ini dihipotesakan terjadi secara
primer melalui gerbang kanal oleh reseptor asam kainik/
quisquolat atau AMPA. Juga mungkin bahwa Na+ dapat
memasuki sel karena gradien konsentrasi melalui kanal
tegangan membran yang tidak tergantung kanal yang
dioperasikan reseptor. Selama iskemia dengan penurunan
produksi ATP, terjadi kegagalan pompa Na+/K+ATPase.
Cedera neuronal tunda dikira sekunder atas influks Ca++
terutama melalui reseptor NMDA yang menggerbangi kanal
kalsium yang dioperasikan reseptor. Serupa dengan
influk Na+, beralasan untuk menduga bahwa dengan gagal
energi dan depolarisasi membran, Ca++ dapat juga masuk
sel melalui kanal kalsium tergantung tegangan, bebas
dari kanal yang dioperasikan reseptor. Karenanya konsep
kematian sel yang berhubungan dengan kalsium yang lebih
mutakhir, merupakan hipotesis eksitotoksik yang nyaris
serupa dengan hipotesis kalsium yang pertama.
Bukti pendukung pentingnya mekanisme eksitotoksik
pada cedera iskemik, pertama, kadar ekstraseluler
glutamat serta aspasrtat meningkat agak banyak selama
hipoksia eksperimental. Kedua, deaferentasi neuron CA 1
dengan Schafferotomi (eliminasi input glutamatergik)
dan injeksi lokal antagonis glutamat mencegah penurunan
kalsium ekstraseluler selama iskemia. Ketiga, antagonis
reseptor glutamat yang kompetitif dan yang tidak
kompetitif tampaknya memperbaiki pada cedera iskemik
baik in vivo maupun in vitro. Keempat, antagonis
reseptor NMDA dan lebih mutakhir, reseptor AMPA,
menurun pada cedera neuronal iskemik baik in vivo
maupun in vitro. Kelima, teori eksitotoksik mungkin
menunjukkan fenomena pengrusakan yang selektif. Iskemia
otak depan pada masa singkat pada tikus Wistar dan
gerbil berakibat cedera yang terbatas pada subikulum
dan hipokampus daerah CA 1 dan CA 4. Iskemik yang lebih
lama berakibat cedera hipokampal CA 3, neuron piramidal
kortikal, nukleus kaudat, dan putamen. Penelitian
ikatan agonis secara radiografis menunjukkan bahwa
reseptor NMDA terkonsentrasi di terminasi kolateral
Shaeffer dari CA 1 dan CA 4, sedangkan reseptor asam
kainik/quisquolat terlokalisir pada daerah terminasi
serabut yang 'mossy' dari CA 3, neuron piramidal,
kaudat dan putamen. Karenanya distribusi daerah
reseptor untuk asam amino eksitatori ini sangat
berhubungan dengan daerah otak dengan toleransi
terhadap iskemik yang rendah.
Karena peningkatan Ca++ intraseluler saat ini dikira
merupakan katalis utama untuk cedera neuronal iskemik,
perlu dipikirkan regulasi kalsium neuronal dan
mekanisme dengan mana kalsium dapat menyebabkan cedera
neuronal. Kenyataan bahwa konsentrasi Ca++ ekstra-
seluler sekitar 10-3, sedangkan konsentrasi intra-
seluler 10-7, perubahan kecil metabolisme kalsium dapat
berakibat nyata pada kegiatan intraseluler yang
bermediasi Ca++, yaitu kontraksi, eksitasi dan sekresi.
Proses ini diketahui pada konsentrasi mikromoler dari
kalsium yang terionisasi. Fluks kedalam kalsium diatur
oleh gradien konsentrasi kalsium antara ekstraseluler
dan intraseluler baik melalui kanal kalsium tergantung
tegangan maupun yang dioperasikan reseptor. Saat ini
diketahui terdapat tiga kanal kalsium membran yang
bergantung tegangan: kanal T,N, dan L. Kanal kalsium
yang dioperasikan reseptor adalah kanal seperti yang
diregulasikan oleh reseptor NMDA untuk asam amino
eksitatori. Sebagai tambahan atas kanal membran ini,
regulator Ca++ lain adalah pompa antiport Na+/K+ yang
elektrogenik dengan rasio sekitar 3 : 1 dimana arah
pertukaran kalsium bisa kedalam atau keluar tergantung
gradien Na+, pompa Ca++ATPase yang terletak dimembrana
retikulum sitoplasmik atau endoplasmik, mitokhondria
dimana secara elektroforetik terjadi akumulasi Ca++
saat kalsium bebas intraseluler meninggi, serta protein
terikat kalsium seperti kalmodulin.
Skema
Teori eksitotoksis cedera neuronal iskemik. Cedera
iskemik dini dikarenakan influks Na+ terutama melalui
kanal yang dioperasikan kainat/quisquolat. Dengan
influks Na+, terjadi influks pasif Cl- dan H2O yang
berakibat edema dendritik diikuti osmolisis. Cedera
iskemik tunda diakibatkan influks Ca++melalui kanal
kalsium tergantung tegangan jenis N yang berakibat
pelepasan neurotransmiter tambahan. Sebagai tambahan
atas kanal yang dioperasikan reseptor NMDA, kalsium
dapat masuk neuron melalui kanal kalsium tergantung
tegangan jenis L. Kanal L ini cenderung terletak dekat
badan se-l. (Fredric B. Meyer, 1993)
Mekanisme utama dimana peninggian Ca++i mungkin
berperan pada cedera neuronal iskemik adalah:
1. Aktifasi enzim degradatif seperti protease,
endonuklease, dan lipase yang mengkatabolis membrana
seluler dan neurofilamen. Hilangnya fosfolipid membran
menambah permeabilitas membran mitokhondrial memberikan
pengaruh pada fosforilasi oksidatif residual, disaat
cedera terhadap struktura neurofilamen menghambat
mekanisme transport neuronal. Sebagai tambahan, asam
lemak bebas yang terakumulasi akibat degradasi fosfo-
lipid membran dikira teroksidasi melalui jalur lipo-
oksigenasi atau siklooksigenasi selama reperfusi. Hasil
jalur ini secara keseluruhan adalah terbentuk dan
dilepaskannya prostaglandin, leukotrin, dan mungkin
radikal bebas. Prostaglandin tromboksan A2 adalah
vasokonstriktor poten, leukotrin merubah permeabilitas
membran dan menyebabkan vasokonstriksi, dan radikal
bebas bila ada, merusak membran seluler.
2. Untuk menyangga peninggian Ca++, mitokhondria
secara elektroforetik tampak mengakumulasi kalsium.
Fosforilasi oksidatif residual yang berdiri sendiri ini
pada saat dimana produksi energi sudah dibatasi oleh
metabolisme anaerobik.
3. Peninggian Ca++i menyebabkan pelepasan neuro-
transmiter yaitu neurotransmiter punitif seperti
glutamat atau aspartat yang melaksanakan siklus
degradatif ini.
Penting untuk memikirkan akibat asidosis otak
disaat memikirkan cedera neuronik iskemik. pH otak
intraseluler sekitar 7.01-7.03. Dalam 10 menit sejak
pengurangan ADS berat, pHi otak memburuk hingga 6.60.
Ini menunjukkan peninggian yang cepat dari konsentrasi
asam laktat intraseluler. Adanya asidosis otak ini
dibuktikan mempunyai efek merugikan berikut, yaitu:
(1) denaturasi protein dengan hilangnya fungsi
enzimatik, (2) penambahan edema glial yang berpotensi
mengganggu aliran kolateral melalui kompresi kolateral
ekstravaskuler dan karenanya mengurangi ADS residual,
(3) berperan meninggikan Ca++i dengan menyaingi H+
untuk tempat ikatan Ca++ intraseluler, (4) akan
mengakibatkan mileu internal yang baik untuk produksi
radikal bebas, dan (5) menekan tingkat metabolik
serebral untuk glukosa dan regenerasi NADH. Percobaan
memperlihatkan bahwa hiperglikemia memperburuk asidosis
intraseluler pada daerah pusat iskemik dan berpengaruh
buruk terhadap kehidupan. Hiperglikemia juga mungkin
memperburuk perfusi serebral pasca iskemik selama
pemulihan ATP dan fosfokreatin, yang mengakibatkan
akumulasi asam laktat jaringan. Walau hiperglikemia
mamperlihatkan efek merugikan pada pusat iskemik
tersebut, ada juga data berlawanan yang menunjukkan
bahwa hiperglikemi mungkin merupakan neuroprotektif
pada penumbra iskemik.
Perubahan Sirkulasimikro
Sebagai tambahan atas perubahan metabolik yang terjadi
selama iskemia, juga terjadi perubahan aliran darah
yang dihantarkan kesirkulasimikro yang dapat berperan
pada cedera neuronal iskemik. Pertama, setelah oklusi
pembuluh terjadi pengentalan darah yang disebut sebagai
particulate flow. Dipostulasikan bahwa particulate flow
ini akibat dari pengurangan tenaga 'shear' yang
cenderung mempertahankan dispersi komponen darah
seluler. Karena pengentalan ini, viskositas darah
meningkat dengan peninggian tahanan terhadap aliran.
Kedua, tampak bahwa pembuluh penghantar permukaan
kortikal selama iskemia fokal menunjukkan progresi
berikut. Pertama, terjadi pertambahan ringan segera
dari diameter pembuluh akibat asidosis ekstraseluler
lokal. Selama vasodilatasi ini, paralisis vasomotor
terjadi dan aliran darah yang melalui pembuluh yang
berdilatasi ini berhubungan langsung dengan tekanan
perfusi serebral. Nyatanya terdapat hilangnya auto-
regulasi tekanan darah dimana jatuhnya tekanan darah
dapat berakibat penurunan yang bermakna dari ADS. Dalam
periode waktu mengikuti vasodilatasi lokal ini, terjadi
vasokonstriksi pembuluh penghantar permukaan yang sama.
Vasokonstriksi ini disebut 'vasokonstriksi iskemik'
atau 'vasospasme sekunder' untuk membedakannya dari
vasospasme yang diinduksi PSA. Vasokonstriksi yang
diinduksi iskemia ini sebagian dihambat oleh pemakaian
antagonis kalsium tertentu yang memblok kanal L yang
tergantung tegangan, menunjukkan untuk sebagian, akibat
dari influks Ca++ kedalam sel otot polos. Diduga,
penurunan ATP berakibat depolarisasi sel otot polos
dengan influks Ca++ diikuti kait-silang aktin dan
miosin. Pilihan teori lain adalah peninggian K+ ekstra-
seluler atau pelepasan vasokonstriktor endogen seperti
norefinefrin atau serotonin. Karena norefinefrin
berperan kritis pada vasokonstriksi iskemik, penting
diingat bahwa deaktifasi norefinefrin adalah bergantung
energi karena ia harus mengalami pengambilan kembali
pada terminal presinaptik. Tidak peduli apapun etiologi
vasokonstriksi iskemik, hasil akhir adalah pengurangan
aliran darah sirkulasimikro.
Perubahan sirkulasimikro ketiga selama iskemia
fokal adalah hipoperfusi pasca iskemik. Hipoperfusi
pasca iskemik atau hipoperfusi tunda setelah gangguan
otak iskemik semula dijelaskan sebagai no reflow
phenomenon. Nyatanya pemakaian istilah no reflow adalah
pemberian nama yang salah dimana derajat hipoperfusi
pasca iskemik tergantung pada beratnya cedera iskemik.
Bila gangguan iskemiknya ringan, secara khas tidak ada
hipoperfusi pasca iskemik. Setelah iskemik berat, hipo-
perfusi pasca iskemik mengikuti perbaikan aliran dapat
dijumpai. Selama hipoperfusi pasca iskemik terjadi
peninggian metabolisme dan ekstraksi oksigen yang
menunjukkan ketidak-serasian antara kebutuhan metabolik
dan penyediaan substrat yang akan menyebabkan cedera
pada neurun yang hidup setelah gangguan iskemik.
Patofisiologi hipoperfusi pasca iskemik disebabkan:
(1) faktor reologis intravaskuler yaitu peninggian
aggregasi platelet atau viskositas darah, atau cedera
leukosit polimorfonuklir terhadap endotelium; (2)
perubahan dinding vaskuler termasuk kontraksi otot
polos, pembentukan mikrovilli, atau edema endotelial;
dan (3) edema ekstraseluler termasuk jaringan glial
menyebabkan kompresi mekanik terhadap bed kapiler.
TINDAKAN TERHADAP ISKEMIA SEREBRAL FOKAL AKUTA
Sebelum membicarakan modalitas tindakan spesifik untuk
iskemia otak akuta, penting untuk menyadari bahwa untuk
mekanisme yang berbeda diperlukan pendekatan serta
tindakan yang berbeda. Misalnya pasien dengan embolus
MCA akibat trombosis mural kardiak mungkin ditindak
dengan terapi trombolitik intravaskuler. Terapi trombo-
litik intravaskuler sebagai tindakan bedah terhadap
pasien iskemia akibat oklusi vaskuler intrabedah yang
lama mungkin merupakan kontraindikasi karena risiko
perdarahannya serta tidak adanya klot intraluminal. Hal
serupa, terapi trombolitik intravaskuler sangat tidak
dianjurkan pada pasien perdarahan subarakhnoid dengan
defisit iskemik akibat vasospasme. Karenanya sebelum
melakukan suatu tindakan, sangat penting menetapkan,
berdasar pada riwayat, pemeriksaan fisik, serta
pemeriksaan diagnostik memadai, perkiraan etiologi dari
kerusakan iskemik.
Sekali etiologi kerusakan iskemik diketahui,
rencana tindakan yang rasional dapat dibuat berdasar
patofisiologi dari cedera otak iskemik. Yang penting,
ada dua prinsip umum dalam menindak strok akut,
meninggikan ADS kolateral dan memberikan proteksi
neuronal langsung.
1. STROK TROMBOEMBOLIK
Etiologi strok tromboembolik heterogen dan kompleks.
Jenis iskemia serebral akuta ini adalah penyebab
tersering dari strok dan memiliki patofisiologis yang
luas seperti embolus dari trombus mural kardiak,
embolus dari stenosis karotid, atau trombosis pembuluh
intrakranial atau ekstrakranial. Karena mekanisme yang
mungkin sangat luas, tindakan terhadap strok trombo-
embolik harus bergantung pada masing-masing pasien.
Misalnya oklusi arteria lentikulostriata berakibat
infark lakuner. Karena lentikulostriata adalah end
artery tanpa aliran kolateral apapun, mungkin tindakan
untuk meningkatkan aliran darah kolateral akan tidak
efektif. Hal serupa, obat neuroprotektif akan tidak
efektif akibat ketidakmampuan penghantaran kejaringan
otak yang iskemik.
Tahap pertama dalam menegakkan diagnosis adalah
mengambil riwayat dan pemeriksaan fisik yang baik.
Riwayat diabetes atau hipertensi bisa mendukung
diagnosis suatu infark lakuner, sedang riwayat serangan
iskemik transien (TIA) sebelumnya, termasuk amaurosis
fugaks, akan mengarahkan pada kelainan kardiak atau
karotid. Bagian terpenting pemeriksaan neurologis
termasuk auskultasi atas bruit servikal dan murmur
kardiak, palpasi denyut arteria temporal superfisial,
dan pemeriksaan oftalmoskopik atas retina akan adanya
emboli atau retinopati venostasis. Setelah pemeriksaan,
CT scan gawat darurat harus segera dilakukan untuk
menyingkirkan penyebab noniskemik dari defisit neuro-
logis seperti perdarahan intraserebral atau neoplasma.
CT scan bisa juga memperlihatkan tanda sekunder dari
infarksi seperti embolus pada MCA atau edema serebral
pada ditribusi vaskulernya. Akhirnya, CT scan mungkin
memperlihatkan kerusakan iskemik lama seperti infarksi
lakuner atau 'watershed' sebelumnya.
Pemeriksaan diagnostik selanjutnya terutama
tergantung kemungkinan klinis. Misalnya bila tidak
direncanakan tindakan intervensi, beralasan untuk tidak
melakukan pemeriksaan pencitraan berikutnya. Tes
diagnostik yang dilakukan bila diperkirakan akan
memberi informasi penting adalah ultrasonografi
karotid, Doppler transkranial, okulopletismografi,
angiogram serebral transfemoral, angiografi MR, dan
ekhokardiografi transesofageal atau transtorasik. Dalam
keadaan yang memadai pada pasien tanpa dengan tanda-
tanda kelainan pembuluh kecil, alasan dibuat langsung
dari hasil CT scan diruang gawat darurat untuk
angiografi untuk menentukan patologi anatomik bila
tindakan yang agresif seperti bedah atau terapi
trombolitik dipertimbangkan.
TINDAKAN
Tindakan atas strok tromboembolik sangat tergantung
pada etiologinya. Saat ini tidak ada tindakan efektif
terhadap infark lakuner akut. Untungnya banyak pasien
ini yang mengalami perbaikan neurologis yang bermakna.
Walaupun saat ini tidak ada agen farmakologis yang
jelas untuk menindak strok tromboembolik, berbagai agen
neuroprotektif potensial seperti antagonis Ca++, dan
pembersih radikal bebas, dalam penelitian klinis.
Karenanya saat ini langkah tindakan berikut dianjurkan:
1. Pertahankan pasien euvolemik. Harus diketahui
bahwa beberapa peneliti menggunakan tehnik hemodilusi
termasuk flebotomi untuk menurunkan viskositas darah
yang secara teori akan meningkatkan aliran mikro-
sirkulasi. Keengganan kita untuk melakukan hemodilusi
adalah berdasarkan adanya bukti kemungkinan hal ini
akan meningkatkan edema serebral dan bukti lain akan
hasil negatif dari peneliti lain.
2. Dilakukan hidrasi pasien dengan NaCl 0.45 atau
0.9, bebas dari glukosa. Ini berdasarkan bahwa hiper-
glikemia memperberat asidosis otak.
3. Pertimbangkan terapi trombolitik. Kontroversi-
nya terletak pada apakah terapi trombolitiknya bedah
atau medikal. Saat ini, terapi trombolitik medikal
adalah dengan pemakaian heparin atau faktor pengaktif
plasminogen jaringan (tPA). Sasaran heparin IV adalah
profilaktik, untuk mencegah embolisme berulang seperti
yang berasal dari trombus mural kardiak atau untuk
mencegah penyebaran trombus kearteria sirkel Willis.
Walau semula dihipotesakan heparin mungkin meningkatkan
aliran mikrosirkulasi, sedikit bukti yang mendukung
postulat ini. Pilihan lain, kebanyakan menyetujui
penggunaan heparin pada pasien dengan embolus kardiak
akibat fibrilasi atrial atau dari embolus paradoksikal.
Pemakaian heparin sebagai pencegah perluasan trombosis
jarang digunakan pada strok spontan. Lebih khusus,
heparin mungkin digunakan pada pasien yang mendapatkan
oklusi arteri untuk mengobati aneurisma intrakranial.
Sebelum memulai heparin, CT scan harus dibuat untuk
menyingkirkan strok hemoragik.
Penggunaan tPA untuk memacu lisis bekuan sedang
diteliti dalam berbagai percobaan klinis prospektif.
Jelas bahwa tehnik paling efektif untuk meningkatkan
aliran darah haruslah yang memperbaiki aliran melalui
pembuluh yang teroklusi. Risiko berpotensi terbesar
dari terapi trombolitik intravaskuler adalah risiko
infarksi hemoragik. Yang mendukung hal ini adalah bukti
penggunaan streptokinase dalam menindak trombosis vena
perifer dalam yang berkaitan dengan insidens perdarahan
intraserebral sebesar 3 %.
Terapi trombolitik bedah adalah ekstirpasi bedah
dari embolus atau trombosis melalui embolektomi MCA dan
endarterektomi karotid secara gawat darurat. Walau
telah dibuktikan manfaat besar dari tindakan agresif
ini, pelaksanaannya belumlah seragam. Mengherankan
bahwa risiko perdarahan intraserebral setelah re-
vaskularisasi bedah sangatlah rendah. Walau ada alasan
bahwa agaknya terapi trombolitik medikal bisa dipilih
dibanding revaskularisasi bedah, tak ada kesimpulan
yang tegas yang dapat ditarik hingga hasil penelitian
tPA selesai dianalisis. Dalam menunggu data tersebut
dipublikasikan, tetap harus diingat bahwa embolektomi
MCA dan endarterektomi karotid secara gawat darurat
dapat sangat menguntungkan dalam memperbaiki fungsi
neurologis pada pasien terpilih.
Apakah terapi trombolitik secara bedah maupun
medikal, masa iskemia dan masa perbaikan aliran tetap
merupakan masalah utama. Penelitian telah membuktikan
bahwa setelah 4 jam sejak iskemia fokal, akan terjadi
infarksi serebral berat. Penelitian juga membuktikan
bahwa perbaikan aliran bahkan setelah 4-5 jam setelah
iskemia akan bermanfaat mengurangi ukuran infarksi.
Penelaahan waktu iskemia dan perbaikan aliran setelah
embolektomi MCA serta endarterektomi karotid tidak
memperlihatkan penggal waktu tertentu dimana perbaikan
aliran setelah selang waktu tersebut menjadi tidak
efektif. Jelas bahwa makin dini tindakan gawat-darurat
dimulai, akan makin baik kesempatan perbaikan klinis.
Umumnya diterima masa 4-6 jam untuk mengusahakan
perbaikan aliran dengan medikal atau intervensi bedah
agresif.
4. Agen protektif serebral. Hingga saat ini belum
ada agen neuroprotektif yang sangat dianjurkan terhadap
strok akut. Antagonis kalsium dihidropiridin nimodipin
sudah dibuktikan sebagai agen neuroprotektif pada
beberapa penelitian terhadap strok akut di Eropa, namun
hasil ini tidak dapat diulangi oleh peneliti Amerika
Serikat. Perbedaan mungkin akibat saat masuk pasien,
yang mencapai 48 jam setelah onset strok akut. Agen
neuroprotektif potensial lain yang sedang diteliti
adalah pemusnah radikal bebas dan antagonis asam amino
eksitatori. Beralasan untuk mempostulasikan, pendekatan
campuran mungkin akan dilaksanakan dimana digunakan tPA
dikombinasikan dengan agen neuroprotektif, masing-
masing sebagai antagonis terhadap mekanisme spesifik
dari cedera iskemik.
OPERASI UNTUK TIA
1. Endarterektomi dan rekonstruksi arteria karotid
ekstrakranial mempunyai morbiditas dan mortalitas
rendah dan sangat besar kesempatannya mencegah TIA
selanjutnya maupun CS.
2. Anastomosis ekstrakranial-intrakranial. Untuk suatu
kelainan yang terletak pada sirkulasi intrakranial,
dilakukan anastomosis arteria temporal superfisial
kecabang permukaan arteria serebral media. Dengan
teknik mikrovaskuler, operasi dilakukan untuk banyak
kelainan accident vaskuler baik akut, kronis, lengkap
maupun tak lengkap.
Disamping operasi, TIA juga dapat ditindak secara
medikal dengan zat-zat antikoagulasi dan antiplatelet.
Antikoagulasi efektif dalam menindak emboli berasal
kardiak dan mungkin mengurangi frekuensi TIA vertebral-
basiler.
Obat yang mempengaruhi sifat adesif platelet
penggunaannya saat ini meningkat dalam menindak TIA dan
mencegah stroke. Inhibisi platelet juga efektif dalam
mencegah TIA dan stroke, mendukung teori TIA sebagai
tromboembolik platelet-fibrin. Aspirin juga sudah
dibuktikan bermanfaat mengobati TIA dan mencegah strok.
Aspirin akan mempengaruhi agregasi platelet dengan
menginhibisi sintesa prostaglandin. Anti agregasi
platelet lain seperti dipiridamol dan sulfinpirazon
tidak memperlihatkan manfaatnya terhadap TIA dan
pencegahan strok. Pada mulanya aspirin diduga hanya
bermanfaat pada pria, namun ternyata menfaat pada
wanita terbukti sama baiknya. Pengurangan kejadian
strok oleh aspirin sekitar 30-50%. Secara teoritis,
dosis pencegahan TIA dan stroke adalah dosis kecil.
Dosis kecil aspirin mungkin tetap menjaga inhibisi
prostasiklin antiagregasi, disaat itu ia juga tetap
menginhibisi tromboksan A2 proagregasi.
Tindakan bedah untuk TIA sirkulasi anterior
terutama adalah endarterektomi karotid. Prosedur
serebrovaskularisasi lainnya seperti pintas ekstra-
intrakranial dicadangkan untuk keadaan khusus. Saat
endarterektomi karotid, plak ateromatosa diangkat
langsung via arteriotomi karotid. Saat ini morbiditas
dan mortalitas tindakan ini kurang dari 3%.
2. ISKEMIA PERIOPERATIF
Beruntung bahwa iskemia serebral perioperatif jarang
terjadi karena membaiknya tehnik bedah mikro. Kadang-
kadang ahli bedah saraf perlu menindak pasien dengan
iskemia perioperatif akibat tindakan oklusi pembuluh
intrabedah yang lama atau cedera pembuluh selama
intrabedah berupa diseksi atau trombosis. Keadaan ini
harus selalu diingat. CT scan gawat darurat dilakukan
untuk mengurangi kemungkinan perdarahan pasca bedah
yang menyerupai kerusakan vaskuler. Harus berhati-hati
terhadap bangkitan pasca bedah karena pelepasan serupa
epileptik terlateralisasi yang periodik (PLED) yang
dapat menyerupai kerusakan iskemik akuta. Bila diduga
cedera pembuluh darah, angiogram gawat darurat harus
didapatkan untuk memastikan patologi anatomik. Lebih
disukai melakukan angiografi dini dari pada melakukan
Doppler transkranial yang tidak invasif secara
terbatas. Bila tampak diseksi atau trombosis pasca
bedah, tindakan agresif segera harus dimulai. Pada
kebanyakan, iskemia perioperatif adalah akibat tindakan
oklusi pembuluh yang lama saat menindak lesi yang sulit
seperti aneurisma raksasa.
TINDAKAN
Sangat tergantung etiologi:
1. Pertahankan pada euvolemik dengan NaCl 0.45
atau 0.9 % dan bebas glukosa. Tidak disukai melakukan
hemodilusi karena menambah edema serebral pasca bedah.
Sebagai tambahan terhadap hidrasi IV, diberikan koloid
seperti albumin 5 % 250 mL secara IV 2-4 kali sehari.
Pola terapi adalah memaksimalkan ekspansi volume,
dengan sendirinya akan meningkatkan aliran kolateral
tanpa menambah edema serebral atau tekanan intra-
kranial.
2. Berikan obat neuroprotektif antagonis kalsium
seperti nimodipin 60 mg lewat mulut setiap 4-6 jam. Ini
berdasar penelitian bahwa nimodipin dapat meningkatkan
ADS dan pengalaman pada PSA yang memperlihatkan bahwa
nimodipin menurunkan beratnya defisit iskemik setelah
PSA.
3. Bila defisit neurologis berat, bisa diberikan
tiopental 3-5 mg/kg secara sinambung dengan drip IV
atau fenobarbital dengan dosis pembebanan 15 mg/kg IM
atau IV diikuti kadar serum terapeutik. Manfaat tio-
pental adalah bahwa waktu paruhnya lebih pendek dari
fenobarbital. Alasan pemberian barbiturat adalah adanya
bukti efek protektif neuronal langsung, pada suatu
iskemia progresif. Sebagai tambahan, barbiturat mungkin
bermanfaat mengurangi edema serebral, yang menurunkan
TIK, dan tentunya akan meningkatkan tekanan perfusi
serebral. Kerugiannya, barbiturat akan mengaburkan
pemeriksaan neurologis, serta perlunya intubasi dan
ventilasi terkontrol.
4. Dalam hal tertentu dianjurkan tindakan bedah.
Misalnya bila angiogram pasca bedah menunjukkan
trombosis atau diseksi, embolektomi atau pintas gawat
darurat harus dipikirkan. Risiko perdarahan peri-
operatif menyebabkan terapi trombolitik intravaskuler
seperti tPA menjadi kontraindikasi. Jarang lobektomi
temporal gawat darurat memberikan manfaat, baik untuk
menhilangkan herniasi transtentorial maupun untuk
meningkatkan tekanan perfusi serebral dengan mengurangi
TIK.
3. DEFISIT ISKEMIK YANG DIINDUKSI PSA
Diagnosis vasospasme secara klinis harus ditegakkan
segera pada kasus dengan persangkaan yang tinggi.
Doppler transkranial atau angiografi adalah pencitra
yang akan menunjang diagnosis bila tidak dijumpai
hidrosefalus pada CT scan.
TINDAKAN
1. Lakukan tindakan hipertensif-hipervolemia
sebagai tindakan awal atas vasospasme segera setelah
aneurisma diperbaiki. Ahli bedah saraf lain ada juga
yang melakukan tehnik hemodilusi. Terapi hipertensif
hipervolemia dimulai dengan hidrasi IV dengan larutan
salin sekitar 125-150 mL/jam. Ditambahkan albumin 250
mL tiap 6 jam. Bila tidak ada riwayat kardiak yang
jelas, curah kardiak ditingkatkan dengan infus iso-
proterenol atau dopamin untuk menaikkan tekanan darah
hingga sekitar 160 mmHg. Dengan infus isoproterenol,
terkadang diperlukan lidokain 1-2 mg IV untuk menekan
iritabilitas kardiak.
2. Karena nimodipin terbukti mengurangi insidens
dan beratnya defisit iskemik, berikan nimodipin sejak
pasien masuk rumah sakit. Namun nimodipin bukanlah obat
ajaib; bila pasien tampil dengan defisit iskemik,
angiografi segera dilakukan untuk menentukan apakah
angioplasti bermanfaat. Angioplasti akan memberikan
beberapa hasil yang baik.
3. Pikirkan pemasangan kateter ventrikuler untuk
mengalirkan CSS. Pada keadaan vasospasme dengan hidro-
sefalus ringan, membuang CSS mungkin secara nyata
memperbaiki ADS.
PILIHAN FARMAKOLOGIS MENDATANG
Analisis kritis terhadap regimen untuk strok akut dan
iskemia perioperatif segera menunjukkan keterbatasan
intervensi farmakologis yang terdedia saat ini. Dengan
perkembangan cepat atas pengertian patofisiologi cedera
otak iskemik, obat lain bisa dikembangkan yang akan
memberikan neuroproteksi dengan menghambat mekanisme
spesifik yaitu kerusakan sel iskemik atau dengan
meningkatkan aliran darah kolateral.
Obat-obat Neuroprotektif yang Potensial
Antagonis Asam Amino Eksitatori. Kemajuan dan
pengertian akan asam amino eksitatori menimbulkan
perhatian yang besar akan pengembangan antagonis yang
kompetitif dan tidak kompetitif terhadap reseptor NMDA
(N-metil D-aspartat) dan yang lebih mutakhir, reseptor
AMPA. Antagonis NMDA nonkompetitif yaitu ketamin,
dizosilpin (MK-801), dan fenilsiklidin (PCP). Agen ini
menghambat kanal ion gerbang-NMDA. Ia segera menembus
SDO karena ia larut lemak. Kemampuan menghambat kanal
ion bergantung tegangan listrik (voltage-dependent) dan
ini memperkuat perkiraan ia kurang efektif saat
depolarisasi masif atau iskemia berat. Antagonis
reseptor NMDA kompetitif adalah fosfonat seperti 2-
amino-5-fosfonovalerat (APV), 2-amino-7-fosfonohepta-
noat (APH), dan senyawa lebih baru yang memperbaiki
penetrasi SDO (CPP, CGS 19755). Lebih baru lagi, anta-
gonis reseptor AMPA (CNQX, NBQX). Antagonis NMDA
terbukti bermanfaat pada iskemia fokal yang diinduksi
oleh oklusi MCA. Pengurangan ukuran infarksi dengan
antagonis nonkompetitif atau yang kompetitif telah
diperlihatkan pada percobaan. Beberapa agen ini seperti
MK-801 terbukti bermanfaat bila diberikan 1-2 jam sejak
onset iskemia fokal. Percobaan memperlihatkan bahwa
antagonis NMDA mengurangi cedera pada jaringan
penumbra. Walau beralasan untuk menduga bahwa agen ini
mengurangi influks Ca++ melalui kanal kalsium yang
beroperasi pada reseptor NMDA, ada beberapa bukti bahwa
ia mungkin bermanfaat pada ADS. Saat ini, antagonis
reseptor AMPA MBQX terbukti mengurangi ukuran infarksi
bila diberikan hingga 90 menit setelah oklusi MCA.
Antagonis Kalsium. Antagonis kalsium bermanfaat baik
karena mengurangi influks kalsium melalui kanal kalsium
bergantung-tegangan atau dengan meninggikan ADS.
Sedikit sekali bukti bahwa antagonis kalsium mencegah
masuknya kalsium keneuron yang iskemik. Peninggian
kalsium bebas intraseluler selama iskemia terjadi
melalui berbagai jalan yaitu kanal kalsium bergantung-
tegangan, kanal kalsium dioperasikan-reseptor, dan
pelepasan dari retikulum endoplasmik. Dalam subgrup
kanal kalsium bergantung-tegangan, ada tiga kanal,
dengan hanya sebuah (kanal L) yang dipengaruhi
antagonis kalsium seperti nimodipin. Antagonis kalsium
lain seperti flunarizin dan nikardipin mungkin juga
mempengaruhi kanal T bergantung-tegangan. Dalam setiap
keadaan, pengaruh antagonis kalsium pada iskemia fokal
adalah seimbang. Walau ada persetujuan bahwa antagonis
kalsium, terutama kelas dihidropiridin seperti nimo-
dipin, nikardipin, atau PN-200-110 meninggikan ADS pada
keadaan iskemik dan non iskemik, pengaruh terhadap luas
infarksi tidak konsisten. Mekanisme perbaikan ADS oleh
antagonis kalsium yang telah dipostulasikan adalah
menghilangkan vasokonstriksoi iskemik, dilatasi
pembuluh darah kolateral pial, atau pengurangan
aggregasi platelet dengan mengurangi viskositas darah.
Terakhir ini, antagonis kalsium dengan efek serotonin
yang disebut S-emopamil memperlihatkan efek perbaikan
pada kerusakan setelah oklusi MCA.
Walau data penelitian tidak konsisten, nimodipin
telah memperlihatkan pengurangan insidens dan beratnya
defisit iskemik setelah PSA. Sebagai tambahan, beberapa
penelitian di Eropa memperlihatkan bahwa pemberian
nimodipin pada pasien dengan strok akut jelas
mengurangi kematian pada terutama pria dan memperbaiki
hasil akhir fungsional dalam jangka panjang. Mungkin
beberapa antgagonis kalsium bergantung-tegangan seperti
nimodipin dan nikardipin akan berperan dalam mengobati
strok akut sebagai bagian dari gabungan terapi.
Pemusnah Radikal Bebas. Terbukti bahwa peroksidasi
lipid bermedia radikal bebas oksigen merugikan pada
iskemia fokal. Dibuktikan bahwa antioksidan endogen
seperti a-tokoferol, askorbat, dan glutation berkurang
selama iskemia fokal. Pemusnah radikal bebas seperti
dismutase dan katalase superoksid yang berkonjugasi
polietilenglikol terbukti mengurangi ukuran infark pada
percobaan iskemia fokal. Terakhir, kelompok 21-amino-
steroid (lazaroid) telah dikembangkan. Aminosteroid ini
tidak memiliki aktifitas glukokortikoid namun beraksi
sebagai pemusnah radikal bebas dan khelator besi.
Senyawa ini memperlihatkan manfaat pada percobaan
cedera kepala, PSA, iskemia fokal, dan iskemia global.
Bila hasil ini telah jelas, 21-aminosteroid mungkin
bermanfaat dalam mengobati strok akut. Seperti dengan
semua pemusnah radikal bebas, pemberian harus dilakukan
sebelum masa reperfusi selama produksi radikal bebas
puncak. Mannitol juga dilaporkan sebagai pemusnah
radikal bebas dan bermanfaat pada iskemia fokal,
menyebabkan beberapa ahli bedah saraf secara rutin
menggunakannya intraoperatif sebelum oklusi pembuluh
saat operasi aneurisma.
RANGKUMAN
Pendekatan rasional pada pengelolaan intensif iskemia
serebral akuta tergantung pengertian akan mekanisme
cedera neuronal iskemik. Pada iskemia serebral fokal,
terdapat pola heterogen pengurangan aliran darah. Pada
daerah pusat dari iskemia yang luas, jarang intervensi
akan bermanfaat dalam mengatasi kerusakan neuronal.
Sekitar daerah pusat iskemia adalah zona dengan iskemia
sedang yang disebut 'penumbra iskemik' yang adalah
jaringan yang potensial untuk diselamatkan. Tehnik
untuk menyelamatkan jaringan cedera yang berkemampuan
reversibel ini dibagi kedalam cara peningkatan aliran
darah kolateral dan tindakan yang memberikan proteksi
neuronal langsung. Pada strok akut yang nonoperatif,
trombolisis intravaskuler mungkin akhirnya menjadi
tehnik terpilih yang dapat memberikan perbaikan aliran
segera. Pada iskemia pasca bedah, cara ekspansi volume
atau mungkin hemodilusi merupakan tehnik terpilih. Obat
yang tersedia saat ini yang mungkin menberikan proteksi
neuronal langsung adalah antagonis kalsium dihidro-
piridin nimodipin dan barbiturat. Mendatang, obat yang
mengurangijalur degradatif spesifik seperti antagonis
reseptor NMDA dan AMPA serta pemusnah radikal bebas
mungkin terbukti efektif.
4. REFERENSI
Untuk rujukan, lihat Bab Daftar Rujukan.