ภาพข้างล่างเป็นหนึ่งในอุปกรณ์เชื่อมต่อกับเครื่องควบคุม pH มีชื่อว่าบิวเรตอัตโนมัติ (Autoburette) ครับ สามารถส่ง กรดหรือเบสลงไปในขวดแก้วรูปชมพู่ (flask) ได้น้อยถึง 2.5 ไมโครลิตร ต่อครั้งนี่เป็นหนึ่งในอุปกรณ์ที่ทำให้เราสามารถควบคุมการเปลี่ยนแปลงของค่า pH ให้อยู่ในช่วงแคบ ๆ ได้ครับ

ความสำคัญของค่า pH
กระบวนการหลาย ๆ อย่างในธรรมชาติต้องพึ่งพิงกับค่า pH มากครับ ปฏิกิริยาทางเคมีที่ทดลองกันในห้องปฏิบัติการและในอุตสาหกรรม ก็มีตั้งหลายกรณีที่ต้องควบคุมค่า pH ในปี พ.ศ. 2452 ผู้ก่อตั้งหลักการ ของค่า pH; S.P.L. Sorensen ได้พิสูจน์ว่าค่า pH จำเป็นเป็นอย่างมาก ในการทำงานของเอนไซม์ (Enzyme) ซึ่งในปีนั้นเขาได้ศึกษากรณีของ เอนไซม์อินเวอเทส (invertase enzyme) ในการย่อยสลายน้ำตาลอ้อย
ค่า pH ยังทำให้สารเคมีหลาย ๆ ชนิดเปลี่ยนสีได้ด้วยครับ เช่นในกรณีของ cyanidin chloride ทำให้ cornflower เปลี่ยนสีจากแดงเป็นน้ำเงิน เมื่อค่า pH เปลี่ยนแปลงจากกรดไปเป็นเบส
อีกตัวอย่างหนึ่งก็คือค่า pH ในกระแสเลือดของคนและสัตว์ ต่างก็ถูกควบคุม ไว้ให้อยู่ในระดับที่คงที่ครับ (เปลี่ยนแปลงอยู่ในช่วงที่แคบมาก ๆ)
ในกรณีของคลอรีนที่เติมลงไปในสระว่ายน้ำก็เช่นกันครับ จะมีค่า pH อยู่ระดับ หนึ่งที่คลอรีนจะไม่ระคายเคืองต่อดวงตาของคนที่ลงไปเล่นน้ำ แต่ในขณะเดียว กันก็ฆ่าเชื้อโรคได้ด้วย
คำจำกัดความของค่า pH
"pH ย่อมาจากคำว่าอะไร ?" นี่เป็นคำถามที่นักเรียนมัธยมปลาย หลาย ๆ คนถาม กันอยู่เสมอ ๆ ครับ คำตอบสมัยที่ผมเรียนอยู่ม.ปลาย เท่าที่จำได้คือ "ไม่แน่ใจ แต่ น่าจะมาจากคำว่า per hydronium ion" แต่คำตอบที่ถูกต้องคือ "pondus Hydrogenii" ครับ ซึ่งนักวิทยาศาสตร์ชาวเดนมาร์ค S. P. L. Sorensen ได้เสนอ คำนี้ขึ้นมาในปี พ.ศ. 2452 มีความหมายว่า "ความเข้มข้นของไฮโดรเจนไอออน ที่น้อยมาก ๆ"
อีกประเด็นหนึ่งทีทุกท่านควรจะทราบก็คือ ในปีพ.ศ. 2452 นั้นค่านิยามของ pH มีค่าเท่ากับ log10[H+] หรือค่าลบของลอการิทึมฐาน สิบของความเข้มข้นไฮโดรเจนไอออน (Hydrogen ion concentration) ในสารละลาย ซึ่งไม่ถูกต้องทีเดียวครับ เพราะว่าในความเป็นจริงปฏิกิิริยาทางเคมีและชีวภาพถูก ควบคุมด้วยค่า activity ของ ไฮโดรเจนไอออน (Hydrogen ion activity) ไม่ใช่ แต่เพียงค่าความเข้มข้นของไฮโดรเจนไอออน ซึ่งค่า activity นี้จะมีค่าเท่ากับ สัมประสิทธิ์ค่า activity (activity coefficient) คูณกับค่าความเข้มข้นของไฮโดรเจน ไอออน อีกทีหนึ่ง ซึ่งหลาย ๆ ท่านที่เรียนวิศวะเคมีกันอยู่ หรือผู้ที่เคยศึกษาเรื่องของ เคมีฟิสิกส์ (Physical chemistry) มาแล้วคงจะทราบครับ
ดังนั้นสูตรของค่า pH ที่เขาใช้กันอยู่ในปัจจุบันก็คือ pH = - log 10aH+ครับ
อิเล็คโทรดวัดค่า pH (pH electrode)
เราสามารถวัดค่า pH ได้โดยการใช้ indicator และ reference electrode ครับ ซึ่งเรา เคยศึกษากันมาแล้วสมัยม.ปลายในเรื่องของปฏิกิริยาเคมีครึ่งเซลล์ ทั้งหลาย ในทางปฏิบัติ บริษัทที่เขาขาย pH electrode จะมีให้เลือกว่าเราต้องการ indicator กับ reference electrode แยกหรือรวมกัน (combined electrode) ครับ อย่างในกรณีของบริษัท Radiometer นั้นเขา มักจะทำแบบแยก และความยาวของ electrode ก็ค่อนข้างสั้นครับ จึงไม่ค่อยเหมาะที่จะเอา ไปใช้ในถังปฏิกรณ์ชีวภาพ (fermentor หรือ bioreactor) เท่าไร แต่ถ้าเป็นของบริษัท Mettler Toledo เขาจะมี custom made เลือกความยาวได้ครับ บางทีสั่งความยาว 40 cm ก็ได้ โดย ทั่วไปราคาของ electrode จะอยู่ประมาณสัก 10,000 บาท หรือแพงกว่าถ้าสั่งทำพิเศษ
หนังสือดี ๆ ที่อธิบายทั้งทฤษฎีและการประยุกต์ใช้เรื่องของ potentiometry ที่ผมอยากแนะนำ ก็คือ
Skoog, D. A., West, D. M., Holler, F. J. 1996. Fundamentals of Analytical Chemistry, 7th edition, Saunders College, New York, Chapter 18, 19. ครับ
เป็นหนังสือที่มีประโยชน์มาก ผมได้ใช้เป็นเอกสารอ้างอิงในเรื่องอื่น ๆ ด้วย ตั้งแต่สมัยเรียนปริญญาตรีจนถึงปัจจุบันครับ ได้ใช้ตั้งแต่หน้าแรกถึงหน้าสุดท้ายเลย
ภาพข้างล่างเป็นตัวอย่างโครงสร้างของ glass electrode (indicator) และ calomel electrode (reference) ที่ใช้กันอยู่ทั่วไปในห้องปฏิบัติการครับ
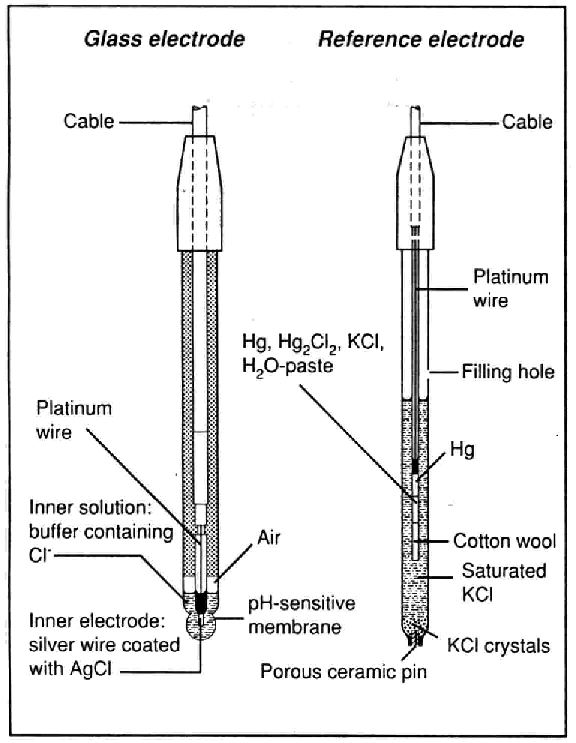
glass electrode, electrode ด้านซ้ายมือ
สัญญาณกระแสไฟฟ้าที่ electrode ส่งออกมานั้น เกิดจากความต่างศักย์ระหว่างด้านในและด้านนอก ของ pH-sensitive glass membrane ครับ ซึ่ง ค่าความต่างศักย์นี้แปรผันกับค่า pH ที่แตกต่างกัน ของสารละลายตัวอย่างที่เราต้องการวัดค่า pH กับ inner solution : buffer containing Cl- (ดูภาพ) การแลกเปลี่ยนไอออนของ inner solution กับไฮโดรเจนไอออนของสารละลายตัวอย่างที่ เราต้องการวัดค่า pH (ซึ่งการแลกเปลี่ยนนี้ถูกควบคุมจากความเข้มข้นของไฮโดรเจนไอออนด้านในและ ด้านนอกของ electrode อีกทีหนึ่ง) นี้เองครับ ที่ทำให้เกิดค่าความต่างศักย์ส่งออกมาให้ pH meter แปลสัญญาณออกมา
โครงสร้างที่ไม่สม่ำเสมอ (not uniform) ของ pH-sensitive glass membrane ทำให้ electrode ยังสามารถวัด ค่าความต่างศักย์ได้ แม้ว่าค่า pH ทั้งด้านในและด้านนอกของ pH electrode จะเท่ากันครับ
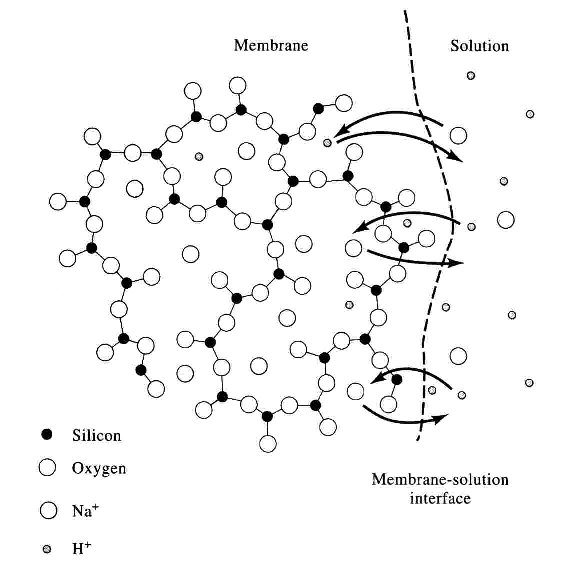
ทีนี้เรามาขยายความเรื่องของ glass membrane กันอีกนิดครับ "เยื่อแก้ว" นี้จะให้ประจุบวกบางชนิดผ่านเท่านั้น อย่างเช่นในกรณีของ Corning 015 glass ซึ่งมักนิยมใช้กันใน pH electrode ประกอบไปด้วย Na2O 22 %, CaO 6%, SiO2 72%
ภาพข้างล่างแสดงให้เห็นถึงการแลกเปลี่ยนไอออนที่ membrane/solution interface ครับ ไฮโดรเจนไอออนจาก สารละลายที่เราต้องการวัดค่า pH จะแลกเปลี่ยนกับไอออนโซเดียมของ glass membrane
การดูแลรักษา pH electrode
การดูแล electrode อย่างเหมาะสมจะทำให้
1. มี response ของค่า pH ที่ดียิ่งขึ้น
2. ทำให้การวัดมีความน่าเชื่อถือ และ
3. ทำให้มีอายุการใช้งานที่ยาวนาน ครับ
อย่างที่ผมได้พิมพ์ไปก่อนหน้านั้นครับว่า pH electrode มีหลายจำพวก พวกที่แยกเป็น indicator (glass electrode) กับ reference (calomel electrode) และ combined electrode ซึ่งมีการดูแลรักษาที่แตกต่างกัน (ระหว่าง glass กับ calomel electrode) สิ่งแรกที่ควรจะทราบก่อนเลย ก็คือ pH electrode ที่เราใช้อยู่เป็นแบบแยก หรือแบบ combined และ ใช้ electrolyte เป็นเป็นปกติ (KCl) หรือไม่ครับ เพราะ electrode บาง ชนิดอาจใช้ LiCl เพื่อใช้วัดค่า pH ในอิมัลชั่น ระหว่าง aqueous กับ organic phase แต่ที่ใช้กันในห้องปฏิบัติการโดยทั่วไปจะเป็น KCl ครับ
การดูแลรักษา Glass electrode
เราต้องแน่ใจว่า glass membrane สะอาดอยู่เสมอครับ โดยทั่วไปถ้าเรา ใช้ pH electrode วัดค่า pH ในสารละลายที่มีน้ำเป็นตัวทำละลาย เพียงแค่ล้างด้วยน้ำกลั่น (distilled water) หรือ reverse osmosis water (RO water) ก็พอครับ หรือถ้าจะให้ดียิ่งขึ้นทำความสะอาดด้วย detergent อย่าง อ่อน ๆ (เช่น 7x) หนึ่งครั้งต่ออาทตย์ด้วยก็ได้ครับ แต่ถ้าต้องใช้ probe วัด ค่า pH ในสารละลายที่มีพวกไขมันหรือโปรตีนอยู่ด้วย อาจต้องใช้น้ำยาทำ ความสะอาดที่มีความแรงยิ่งขึ้น เช่น สารละลาย alkaline hypochlorite ครับ สิ่งสำคัญก็คืออย่าปล่อย pH probe ทิ้งไว้หลังจากการวัดด้วยไม่ล้าง สารละลายที่กำลังวัดอยูออกด้วยน้ำกลั่นครับ
ถ้า probe ที่คุณนู๋นันใช้เป็น combined electrode อาจต้องจุ่ม electrode ใน สารละลาย alkaline KCl (3 M KCl 10 ส่วน ผสมเข้ากับ สารละลายบัฟเฟอร์ pH 9.2 2 ส่วน) ที่ต้องใส่ สารละลายบัฟเฟอร์ pH 9.2 ลงไปด้วยก็เพื่อป้องกัน ไม่ให้ electrode เสื่อมสภาพเร็วกว่าที่ควรจะเป็นครับ สำหรับเรื่องของการ calibrate ควรทำทุก ๆ 24 ชั่วโมงครับ
ในระหว่างการวัดค่า pH, ควรจุ่ม glass electrode ในน้ำกลั่นหรือน้ำ RO หรือใน buffer pH 4.0 ครับ ถ้าใช้ pH probe กับสารละลายที่มีความเป็น ด่างสูงเป็นระยะเวลานาน ๆ หรือ มี HF (Hydrofluoric acid, กรดกัดแก้ว) เป็นองค์ประกอบอยู่ด้วยจะทำให้อายุการใช้งานของ electrode สั้นลงมากครับ เพราะ glass membrane จะค่อย ๆ ละลายหายไป ปฏิกิริยา การทำลาย glass membrane ในสภาวะเหล่านี้จะเร็วขึ้นอีกมาก ที่อุณหภูมิ สูง ๆ ครับ
ถ้าไม่ใช้ electrode เป็นระยะเวลานานกว่า 2 อาทิตย์ ควรจะเก็บ electrode แบบแห้ง (dry storage) ครับ
combined electrode
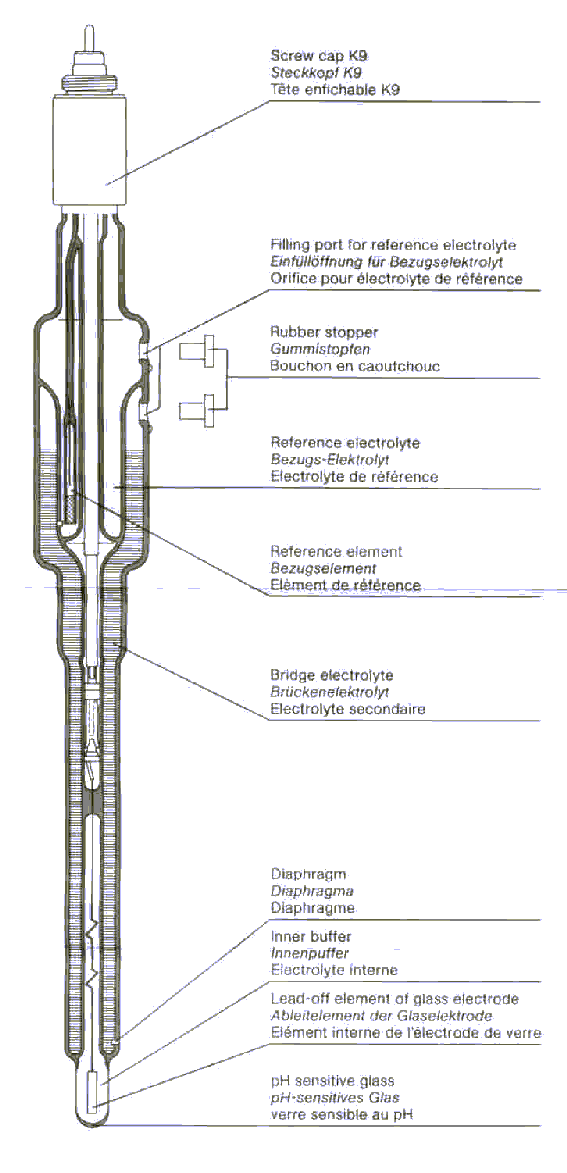
ตอบคำถามของคุณคำถามที่ 1 ครับ
บางทีถ้า electrode เก่ามาก ๆ อาจต้องซื้อใหม่ครับ เพราะตามอายุการใช้งาน ทั่วไปของ electrode มักไม่เกิน 2 ปี แต่อาจจะลองหลาย ๆ วิธีดังนี้ ครับ
1. ตรวจสอบดูว่ามีฟองอากาศอยู่ในส่วน inner solution หรือ inner buffer หรือไม่ (ดูภาพของความคิดเห็นที่ 12 และ 27 ครับ) ถ้ามีอยู่ตรงบรเวณที่ inner reference electrode จุ่มอยู่พอดี อาจ ทำให้ค่า pH ที่อ่านออกมาไม่คงที่ อาจต้องสะบัด electrode ไปมา (ระวัง แตกนะครับ) เพื่อให้ฟองอากาศย้ายตำแหน่งไปส่วนอื่น แต่ถ้าฟองอากาศ ถูกขังอยู่ระหว่างผลึกของ KCl อาจต้องจุ่มส่วนปลายของ electrode ลงในบีกเกอร์ที่มีน้ำอุ่นอุณหภูมิ 60 องศาเซลเซียสอยู่ครับเพื่อละลายผลึก และขจัดฟองอากาศออกไปจากส่วนของ inner reference electrode
2. ทำความสะอาดโดยการจุ่มส่วนปลาย electrode ลงในสารละลาย ammonium bifluoride ความเข้มข้น 20% (w/v) เป็นเวลาหนึ่งนาที จากนั้น จุ่มลงในกรดไฮโดรคลอริค (HCl) ความเข้มข้น 6 M เป็นเวลา 15 วินาที แต่ต้องทำด้วยความระมัดระวังมากครับ เพราะอาจมี กรดกัดแก้ว (HF) เกิดขึ้นได้ หลังจากผ่านกระบวนการนี้แล้วก็แช่ electrode ไว้ใน น้ำกลั่น, RO water หรือ สารละลายบัฟเฟอร์ pH 4.0 เป็นเวลา 24 ชั่วโมง
อีกประการหนึ่งที่เป็นไปได้ก็คือ ถ้าสารละลายบัฟเฟอร์มาตรฐานที่คุณใช้ อยู่เป็น pH 10.0 อายุการใช้งานของสารละลายนี้จะไม่นานครับหลังจาก เปิดขวด เพราะคาร์บอนไดออกไซด์ที่อยู่ในอากาศอาจละลายลงไปทำให้ ค่า pH เปลี่ยนได้ (อายุการใช้งานน้อยกว่า 1 เดือน หลังจากเปิด) คุณอาจ ลองใช้วิธี nitrogen blanketing บนผิวของสารละลายบัฟเฟอร์หลังจากเปิด ขวดแล้ว อาจทำให้เก็บไว้ในนานขึ้นครับ
แล้วทำไมเวลาใช้ pH Meter ถึง
ต้องมี probe วัดอุณหภูมิ ด้วยละคะ
เวลาตัวเลขอุณหภูมิเปลี่ยนไป ค่า pH ก็จะผันแปรไปเล็กน้อย
จากที่เคยเรียนมา pH = -log[H+] ใช่มะ อ้าวแล้วตกลง pH ขึ้นกะอุณหภูมิด้วยรึเปล่าคะเนี่ย ??
ใช่ครับนู๋นัน ค่า pH เปลี่ยนไปตามอุณหภูมิ ดังนั้นเครื่องวัด pH ดี ๆ มักจะต้องมี สายต่อเข้า กับ Probe วัดอุณหภูมิด้วยเสมอครับ สำหรับรายละเอียดที่จะอธิบายว่าทำไมก็มีดังนี้ครับ
สมการที่ใช้อธิบายความสัมพันธ์ระหว่าง ค่าความต่างศักย์ของอิเล็กโทรด (Electrode potential) กับอุณหภูมิและค่า activity ของโปรตอน (aH+) เรียกว่า Nernst Equation ครับ ซึ่งมีรูปแบบ ดังข้างล่าง
Nernst Equation

เมื่อ (จากสมการ 1)
E คือค่าความต่างศักย์ที่วัดได้ระหว่าง indicator กับ reference electrodes (Eind - Eref) (mV)
E0 คือค่าคงที่ของความต่างศักย์ซึ่งแปรผันกับอุณหภูมิ (mV)
R คือ gas constant (8.3144 J/K)
T คือ อุณหภูมิสัมบูรณ์ (K)
F คือ ค่าคงที่ของฟาราเดย์ (Faraday's constant, 96485 คูลอมบ์)
สมการของ Nernst ที่เห็นนี้ยังไม่ได้ถูกจัดรูปใหม่ให้โยงค่า pH เข้ากับอุณหภูมิครับ


คุณ Thermoman ครับ ในกรณีที่เรากำลังพิจารณาอยู่นี้เป็นการตอบปัญหาที่ว่าทำไมเครื่อง วัด pH จึงต้องมี Temperature probe อยู่ด้วยครับ แต่ที่คุณ Thermoman หมายถึงคือ การเปลี่ยนแปลงค่า pH ของตัวสารละลาย buffer ต่าง ๆ ซึ่งสารละลาย buffer แต่ละชนิด ก็มีความสัมพันธ์ของค่า pH กับ ค่าอุณหภูมิที่แตกต่างกันครับ ถือเป็นคุณสมบัติเฉพาะ ตัวของสารละลายชนิดนั้น ๆ ซึ่งต้องวัดเป็นกรณีไป เหมือนกับ colligative properties หรือ vapour equilibrium constant ของสารเคมีต่างชนิดกันครับ... เครื่องวัด pH ไม่ทราบหรอกครับ ว่าตัวมันกำลังวัดค่า pH ของสารละลายชนิดไหนอยู่แต่ตัวเครื่อง ต้องการค่าของอุณหภูมิเพื่อนำไปโยงความสัมพันธ์ระหว่างค่าความต่างศักย์ของอิเล็กโทรด กับค่า pH เพื่อใช้ในการ calibrate ครับ ซึ่งผมจะได้อธิบายรายละเอียดต่อไป รวมถึงเรื่องที่ คุณ Thermoman หมายความถึงด้วยครับ
ตั้งแต่ตรงนี้ไปนู๋นันต้องทำความเข้าใจนะครับว่าเรื่องของอุณหภูมิกับ pH มีอยู่สองมุมมอง ถ้าไม่เข้าใจอาจทำให้เขวไปได้ครับ
มุมมองที่หนึ่ง ค่า pH ของสารละลายต่าง ๆ ขึ้นอยู่กับอุณหภูมิซึ่งมีความสัมพันธ์ pH = A/T + B + C*T + D*T2 เมื่อค่า T เป็นอุณหภูมิในหน่วยของเคลวิน ส่วนค่า A, B, C, และ D เป็นค่าคงที่ซึ่งแตกต่างกันไปตามชนิดของสารละลาย เหมือนกับ Antoine's equation ไงครับ
มุมมองที่สอง เครื่องวัด pH ไม่มีทางรู้เลยว่าตัวอิเล็กโทรดของมัน กำลังอยู่ในสารละลาย บัฟเฟอร์ชนิดไหน ที่มี Temperature probe เอาไว้ไม่ใช่เอาค่าอุณหภูมิไปคำนวณว่า "ขณะนี้อิเล็ก โทรดจุ่มอยู่ในสารละลายฟอสเฟตบัฟเฟอร์ ที่อุณหภูมิ 30 องศาเซลเซียส และที่อุณหภูมินี้ บัฟเฟอร์ ดังกล่าวจะมีค่า pH ที่...." ไม่ใช่อย่างนั้นนะครับ เพราะเครื่องวัด pH ไม่มีทางรู้เลยว่ากำลังวัด ค่า pH ของสารละลายอะไรอยู่ที่ความเข้มข้นเท่าไหร่ แต่เครื่องต้องการให้เราป้อนค่าอุณหภูมิลงไป เพื่อประโยชน์ในการ calibrate ค่าความต่างศักย์ระหว่าง indicator กับ reference probe ครับ
นี่เป็นตัวอย่างตารางค่าคงที่ของสมการที่แสดงไว้ในมุมมองที่หนึ่งครับ

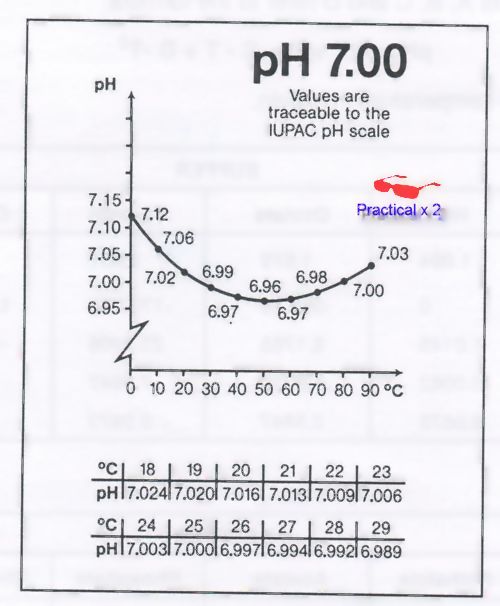
และเพื่อให้เห็นชัดเจนขึ้นอีก นี่เป็น profile ความสัมพันธ์ระหว่างค่า pH กับ อุณหภูมิของ สารละลายบัฟเฟอร์มาตรฐาน pH 7.0 ของบริษัท RADIOMETER ครับ
ถ้าเราพิจารณาสมการที่ 4 ให้ดี ๆ จะเห็นว่า มีตัวแปรที่เราไม่ทราบว่าก่อนการ calibrate อยู่สองตัวครับ คือ pH0 กับ ค่า sensitivity นี่คือเหตุผลที่ทำไมเราต้องทำการ calibrate โดยใช้ pH buffer 2 ชนิด เช่น pH 4 กับ 7 หรือ pH 7 กับ 10 ครับ เพราะสมการหาค่า pH ของเครื่องวัด pH เป็นสมการ 2 ตัวแปรนั่นเอง (ค่า E, T, และ pH ขณะนั้น ๆ เครื่องจะทราบจากการ calibrate นั่นเองครับ) แต่เครื่อง pH บางเครื่องอาจอนุญาตให้ทำการ Calibrate โดยใช้สารละลาย pH มาตรฐานเพียงตัวเดียว ในกรณีเร่งรีบจริง ๆ โดยเครื่องวัด pH จะใช้ค่า sensitivity ของ electrode ที่ได้คำนวณเอาไว้แต่ครั้งก่อนมาใช้ครับ ดังนั้น calibrate โดยใช้สารละลาย pH มาตรฐานเพียงชนิดเดียว เครื่องก็สามารถคำนวณค่า pH0 ออกมาได้ครับ
ยกตัวอย่างครับ ผมเพิ่งไปวัดค่าความต่างศักย์ของ electrode ของสารละลาย pH มาตรฐาน 4 กับ 7 ที่อุณหภูมิ 20 องศาเซลเซียส (293 K) จากเครื่องวัด pH ที่ผมมีอยู่ใน lab มาครับ อ่านได้ค่าความต่างศักย์ electrode ที่อุณหภูมิต่าง ๆ เป็นดังนี้ pH 4.0, E = 146 mV, pH 7.0, E = -22 mV [ผมอยากแนะนำให้ทุกท่านที่มี pH meter ลองทำการทดลองนี้ดูครับ เพราะเป็นการทดลองง่าย ๆ และเราจะได้เข้าใจหลักการทำงานของ pH meter ดียิ่งขึ้น] พอแก้สมการออกมาแล้วเราจะได้ค่า pH0 = 6.607 และค่า sensitivity = 96.4 % ดังวิธีการทำโดยละเอียดข้างล่างครับ


มาถึงตรงนี้ผมจะแถม Trick ในการ calibrate ให้ด้วยครับว่า ควรจะเริ่ม calibrate ด้วย pH 7.0 ก่อน pH 4.0 เพื่อลดความเสี่ยงของ Proton contamination ครับ
1. ไม่ใช่ครับ เพราะตัวเครื่อง detect ได้ว่ามี temperature probe ต่อกับตัวเครื่องวัด pH ครับ เมื่อพบว่าไม่มี ตัวเครื่องก็จะถามผู้ใช้ให้ป้อนค่าอุณหภูมิของบัฟเฟอร์ลงไปใน เครื่องครับ (ซึ่งเราสามารถใช้เทอร์โมมิเตอร์ธรรมดา วัดอุณหภูมิของสารละลายและป้อน ค่าอุณหภูมิเข้าไปครับ), ถ้าป้อนผิดก็แน่นอนว่าค่า pH0, sensitivity ก็จะถูกคำนวณออก มาผิดไปด้วยครับ ทำให้วัด pH ของสารละลายตัวอย่างได้ไม่ถูกต้อง
2. ถึงเครื่องจะมี temperature probe แต่ถ้าเราไม่ได้จุ่ม probe ลงไปในสารละลายที่เรา ต้องการวัดค่า pH, ก็จะทำให้เราอ่านค่าได้ไม่ตรงความจริงอยู่ดีครับ
ตอบสั้นๆ cross-sensitivity ครับ วัดอุณหภูมิ เพื่อทำ Temperature Compensation ครับ
ผมว่าคุณ Appendix กับคุณ Practical x 2 เข้าใจตรงกันว่า Probe temperature มีไว้ทำหน้าที่อะไร แต่รายละเอียดในการอธิบายความอาจไม่ตรงกันบ้างผมว่าถูกทั้งคู่ หน้าที่มันเพื่อ temperature compensation ผลตามการประยุกต์ Nernst equation เป็น E = Ex- 1.98 Tk pH อ้างอิงจากhttp://www.omega.com/techref/ph.html อย่างไรก็ตามกรณีนี้จะเรียกว่า cross sensitivity หรือเปล่าผมไม่แน่ใจ คำนี้ปกติจะใช้เมื่อเกิด interference กับ sensor เช่น strain gage วัดแรง โดยอาศัียความสัมพันธ์ของการยืดกับความต้านทานไฟฟ้า แต่ความต้่านทานก็มีผลจากอุณหภูมิ เทคนิคในการ compensate ก็อาศัยการต่อวงจรให้ผลของอุณหภูมิมันหักล้างกันเองแต่ในกรณี pH meter การทำงานมันอาศัยหลักการ ตามสมการ E = Ex- 1.98 Tk pHในกรณีนี้มันมี T เป็นตัวแปรร่วมอยู่ตรงๆ ต่างกับกรณี Strain gage ไม่มากก็น้อย การ compensate เป็นการวัดค่า T เพื่อเอามาใส่ในสูตรใครแม่นเรื่องคำเทคนิคลองชี้แจงมา
เมื่อเราต้องการวัด A เราต้องการ ผลลัพท์ X ที่เป็นฟังก์ชั้นของ A หรือ เขียนได้ว่า X = f(A) เมื่อใดก็ตามที่ X ไม่ได้เป็นฟังก์ชั่นของ A แต่เพียงอย่างเดียว เช่นเป็นฟังก์ชั่นของ A และ B เขียนได้ว่า X = f(A,B) เมื่อนั่น เราก็เรียกว่ามี cross-sensitivity คือ เราจะวัด A แต่ผลลัพธ์ดั้นไม่ได้ sensitive กับ A อย่างเดียวแต่ไป cross-sensitive กับ B ด้วย เป็นต้น
ความต้านทานของ Strain Gage เขียนได้เป็นฟังก์ชั่นของ T และ F ครับ ไม่ต่างอะไรกับ pH-Sensor ครับ เช่น R = f(T,F) การแก้ก็ทำให้หลายอย่างอย่างครับ อย่างคุณป้อมยกมาคิดว่าเป็น Differential Technique โดยต่อ WheatStone Bridge ให้มี commonmode rejection มอง Temp ว่าเป็น noise
คุณ appendix กับคุณ Pom.com คงเข้าใจเรื่องอิเล็คโทรนิกส์ ดีกว่าผมครับ จุดมุ่งหมาย การวัดค่าอุณหภูมิแท้จริงก็อาจเป็นอย่างที่ว่าครับ ผมเพียงแต่พยายามอธิบายสิ่งที่เครื่อง วัด pH แสดงผลออกมาครับ ซึ่งหลาย ๆ คนอ่าจไม่ทราบเช่นค่า sensitivity ครับ ว่าคำนวณ มาได้อย่างไร