| [Anterior] [Indice] [Siguiente] | ||
MODELO ATOMICO DE BOHR
Antes de que Bohr llegara a plantear su modelo atómico, el cual es el que mayor validez tiene hoy en día, existieron varios científicos que plantearon su propio modelo atómico. Los modelos más importantes fueron :
Modelo atómico de Thomson:
Según Thomson los electrones se encuentran sumergidos dentro de una esfera de materia de carga positiva, uniformemente distribuida en ella. Necesariamente la cantidad de carga negativa era igual a la cantidad de carga negativa para que el átomo fuera neutro.
Los electrones ocupaban ciertas posiciones de equilibrio dentro de la esfera de materia, de manera que las fuerzas electrostáticas estaban equilibradas y el sistema como un todo era estable. Además podían oscilar alrededor de su posición de equilibrio y emitir radiación electromagnética.
 Para comprobar el modelo de Thomson se propuso realizar un experimento en el cual se observara el comportamiento de partículas a (carga positiva) que realizan colisiones con átomos de una lámina muy delgada de oro.
Para comprobar el modelo de Thomson se propuso realizar un experimento en el cual se observara el comportamiento de partículas a (carga positiva) que realizan colisiones con átomos de una lámina muy delgada de oro.
De acuerdo con el modelo atómico de Thomson, las partículas a serán desviadas con respecto a su trayectoria incidente solamente si atraviesan el átomo. Fuera de éste, el efecto del campo eléctrico es muy débil, ya que la carga positiva del átomo esta distribuida uniformemente dentro del volumen de la materia; el campo eléctrico en un punto dado dentro de él es débil y su efecto sobre las partículas a será desviarlas poco con respecto a su dirección incidente.
Modelo atómico de Rutherford :

Rutherford decide también realizar pruebas del modelo de Thomson, mirando el comportamiento de las partículas
a al colisionar con una lamina delgada de oro. Como las partículas no se pueden ver, detrás de la lámina se coloca una pantalla de sulfuro de Zinc, que permite detectar las partículas a desviadas al atravesar la lámina, al producir destellos de luz cada vez que una de ellas hace impacto.Los resultados que arroja el experimento son en cierta manera contradictorios, ya que efectivamente muchas partículas
a siguen su trayectoria o son desviadas muy poco con respecto a su incidencia, tal como lo predijo Thomson; pero algunas partículas a se desviaban demasiado, y otras se devolvían. Estos dos últimos resultados contradecían el modelo atómico de Thomson.
A raíz de los resultados Rutherford propone un nuevo modelo atómico en el cual el átomo está formado por un pequeño núcleo de materia donde se encuentra concentrada toda su carga positiva y la mayor parte de su masa, y a cierta distancia de él, se encuentran distribuidos los electrones en cantidad tal que la carga neta del átomo es nula. Al estar concentrada toda la carga positiva en un pequeño volumen se crea a su alrededor un campo eléctrico muy fuerte de manera que si una partícula
a (cuya carga es positiva) pasa en su vecindad la fuerza eléctrica de repulsión que actúa sobre ella hará que se desvíe de su dirección incidente con ángulos grandes si pasa cerca del núcleo, con ángulos pequeños si pasa un poco más lejos. Las cargas positivas del núcleo se llaman protones; la carga total del núcleo es Ze donde Z es el número atómico.
 Rutherford realiza la teoría de las partículas a partiendo de las siguientes suposiciones :
Rutherford realiza la teoría de las partículas a partiendo de las siguientes suposiciones :
Las anteriores suposiciones sirvió para que Rutherford planteara la teoría de la dispersión de partículas a. Las asíntotas incidente y de dispersión forman un ángulo v llamado ángulo de dispersión, que es el ángulo que se desvía la partícula a con respecto a su dirección original. Si no existiera la fuerza eléctrica de repulsión en la partícula a y el núcleo, la primera pasaría a una cierta distancia b del núcleo, llamada parámetro de impacto. Entre el ángulo de dispersión y el parámetro de impacto existe una relación inversa: a menor parámetro de impacto, mayor ángulo de dispersión. La relación exacta entre le ángulo de dispersión v y el parámetro de impacto b es :
![]() , donde K es la energía cinética de la partícula a y Z el número atómico del núcleo considerado.
, donde K es la energía cinética de la partícula a y Z el número atómico del núcleo considerado.
En el modelo atómico de Rutherford, de acuerdo con la mecánica clásica, el sistema electrón-núcleo sólo será estable si los electrones giran alrededor del núcleo describiendo órbitas circulares o elípticas; pero este hecho presenta un grave problema desde el punto de vista de la teoría clásica, ya que al ser cargas eléctricas en movimiento acelerado deben emitir radiación, por lo que los electrones deberían ir perdiendo su energía y su trayectoria se transformará en un espiral para finalmente llegar la núcleo y el átomo se desintegraría. Esto no ocurre en la naturaleza.
Modelo de Bohr :
Basando se en el trabajo de Rutherford y en la teoría de Planck, Bohr planteo los siguientes postulados:
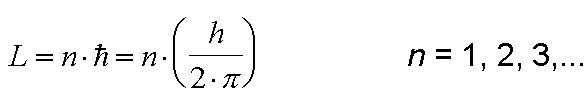 Para un electrón sólo es posible moverse en una órbita para la cual su impulso angular orbital L es un múltiplo entero de la constante de Planck dividida entre (2*pi.).
Para un electrón sólo es posible moverse en una órbita para la cual su impulso angular orbital L es un múltiplo entero de la constante de Planck dividida entre (2*pi.).Con sus postulados Bohr resolvió varias inquietudes; por ejemplo con el 1er postulado dejo en claro que era válida la existencia de un núcleo con carga positiva; con el 2do y 3er postulado quedo planteada la cuantización, con lo que se soluciono en parte el inconveniente del modelo de Rutherford; y con 4to hizo un paralelo con la teoría de Planck, quien decía que un oscilador sólo emite energía cuando pasa de un estado de mayor energía a otro de menor energía.
Bohr decidió trabajar con el átomo del hidrogeno ya que presentaba una gran facilidad el hacer sus pruebas con la presencia de un solo electrón.
Con el modelo ya definido, como se ve en la figura, Bohr realizo el siguiente planteamiento.
La condición de órbita estable es :
F(centrípeta) = F(eléctrica)

De la anterior ecuación se despeja v que es la velocidad de electrón en alguna de las órbitas permitidas

El impulso angular orbital del electrón deberá ser una constante ya que la fuerza que actúa sobre el electrón está por entero en la dirección radial.

Con la anterior ecuación, y con la hallada para la velocidad, se puede establecer una ecuación que indique el radio de las orbitas permitidas. Esta ecuación es :
![]()
Bohr hizo un calculo con la formula anterior, para la primera orbita (n=1) del átomo de hidrogeno (Z=1), y el resultado fue de r1 = 0.0529nm = 0.53
Œ. A este valor se le dio el nombre de radio de Bohr y se denota como ao.La energía total del electrón está dada por la suma de su energía cinética y su energía potencial eléctrica; entonces:

Reemplazando en esta ecuación la velocidad y el radio por sus expresiones correspondientes encontradas anteriormente, se obtiene:

La anterior ecuación permite calcular la energía del electrón en cualquiera de las orbitas permitidas.
El signo negativo indica que el electrón está ligado al núcleo y no tiene suficiente energía para escapar de la atracción que se ejerce sobre él.
Cuando el número cuántico n es infinito la energía total del electrón es nula. A partir de ese momento queda libre las fuerzas que actúan sobre él y podra moverse libremente con cualquier energía. Cuando el número cuántico n es igual a la unidad, el átomo se encuentra en su menor estado energetico denominado estado base o fundamental. Para el hidrogeno la energía de este estado es :

A los niveles de energía correspondientes a n= 2, 3,.... se les llama estados excitados.

De acuerdo con el último postulado de Bohr, la frecuencia de la radiación emitida será:

Si se exprea la frecuencia en función de la longitud de onda, la relación anterior se transforma en

El modelo átomico de Bohr pudo explicar la presencia de líneas en el espectro átomico del hidrogeno: cada linea corresponde a una transición electrónica desde un nivel energético hasta otro de menor energía. Estas lineas fueron descubiertas por otros cientificos.
El modelo atómico de Bohr se puede utilizar para describir átomos que por algúna causa han perdido todos los electrones salvo uno, con lo cual se parecen a un átomo de hidrogeno. Estos átomos se denominan "átomos hidrogenoides".
| [Anterior] [Indice] [Siguiente] | ||